
科目: 来源: 题型:
【题目】若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1 mol,反应产物中的有机物只有四氯乙烷)
A.取代,4 mol Cl2
B.加成,2 mol Cl2
C.加成、取代,2 mol Cl2
D.加成、取代,3 mol Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学--选修5:有机化学基础]氰基丙烯酸酯在碱性条件下能快速聚合为![]() ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
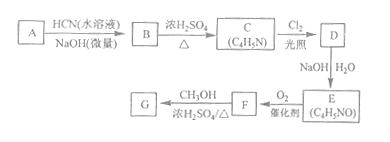
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:Cl-、SO42-、SO32-、NH4+、Na+。为确认溶液组成进行如下实验:①100mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.50g。若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶,同时产生能使湿润的品红试纸褪色的气体。②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.56L(已换算成标准状况,假定产生的气体全部逸出)。
A.一定存在SO42-、SO32-、NH4+,可能存在Na+
B.一定存在SO42-、SO32-、NH4+,一定不存在Cl-、Na+
C.溶液中可能含有Cl-,且Na+浓度至少为0.15mol/L
D.c(SO32-)=0.1mol/L,c(NH4+)<c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):
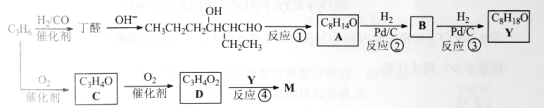
完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到![]() 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式,C________________ D________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基 ②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)

(1)e处反应的离子方程式为____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为_____ ___。
(2)b处的实验现象为_________________________。
(3)c处反应的化学方程式为____________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较 Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是
选项 | 污染物 | 处理措施 | 方法类别 |
A | 废酸 | 加生石灰中和 | 物理法 |
B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
C | 含苯废水 | 用活性炭吸附 | 物理法 |
D | 含纯碱的废水 | 加石灰水反应 | 化学法 |
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料。为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,某化学兴趣小组设计探究实验,操作过程如图所示:(A试剂有挥发性):
(1)操作过程中的试剂:A是______________盐酸、过滤
,B是______________;氢氧化钠、过滤
;;
(2)溶液甲到溶液乙的离子方程式为______________;
(3)在溶液乙中通入过量C02后发生反应的离子方程式为______________;
(4)如果A、B试剂互换,则C02应换为____________试剂,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______________Al2O3、NaCl
(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
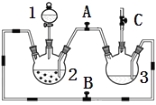
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次来 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52[ | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为
滴定终点的现象是
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学选修5有机化学基础]有机物F是一种重要的医药中间体,以化合物A(相对分子质量为126.5)为原料合成F的工艺流程如下:

已知:
(1)A的结构简式为 ,D分子中含氧官能团的名称为_______,反应B→C的反应类型为 。
(2)1molC在一定条件下最多能与______mol NaOH反应。
(3)已知D与SOCl2反应除生成E外还有两种易溶于水的气体生成,反应的化学方程式为 。
(4)满足下列条件的有机物D的同分异构体有______种。
①属于1,3,5—三取代苯; ②能发生银镜反应; ③能与氯化铁溶液显紫色
(5)B在生成D反应过程还可得到另一种副产物G( ),下列有关G的叙述正确的是 。(填选项)
),下列有关G的叙述正确的是 。(填选项)
A.能与乙二醇通过加聚反应得到高分子材料
B.能发生取代反应和加成反应
C.该分子中最多有8个碳原子共平面
D.该分子中最多有1个手性碳原子
(6)根据已有知识并结合相关信息,写出以化合物CH2(COOC2H5)2为有机反应原料制备CH3OCOCH2CH2CH2CH2COOCH3的合成路线流程图(注明反应条件,无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com