
科目: 来源: 题型:
【题目】实验测得,某有机物A相对分子质量为72。
(1)若A是烃,其分子式为______,它有_____种同分异构体,沸点最高的是__________________ (写结构简式)。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该A的结构简式为______。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则A的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分:
族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
I. 请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图______________。
(2
(3)元素④和⑥形成的化合物的电子式:____________________。
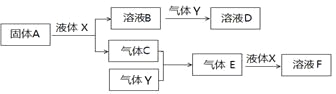
II. 由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,写出过量的Y与B
溶液反应的离子方程式__________________________________________________
(6)若气体C与Y在恒容绝热的条件下反应,下列哪些说法说明该反应达到平衡状态:_______
A. 温度不变
B. 2v正(C)=v逆(Y)
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期A、B、C、D4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D与B属于同一族元素。
(1)元素:A为______,B为______,C为______(填元素符号)。D的质子数和中子数相等。D原子组成符号为:______。
(2)写出AB2的电子式 。
(3)用电子式表示B、C两元素形成E的过程 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2 L密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g) 3C(g)。经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。已知反应开始时B的浓度是0.5 mol/L。则:2 min末B的浓度为______,C的物质的量为______。2 min内的反应速率,V(A)=______, V(C)=______,B的转化率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】量取16.0mL 10.0molL﹣1HCl溶液,加蒸馏水稀释至100mL,取两份稀释后的HCl溶液各25mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积),请计算:

(1)稀释后HCl溶液的物质的量浓度为 mol·L-1。
(2)加入Al的质量至少有 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
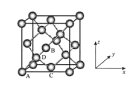
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
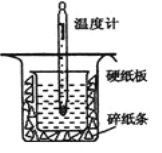
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________,除此之外,装置中的一个明显错误是 。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________ ___(填“相等”、“不相等”),若实验操作均正确,则所求中和热________ ___(填“相等”“不相等”)。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com