
科目: 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
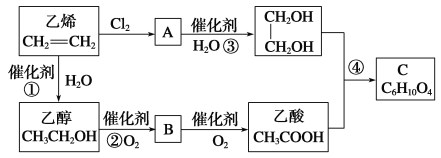
(1)写出A的结构简式:________________
(2)乙酸分子中的官能团名称是_________,写出1种可鉴别乙醇和乙酸的化学试剂: _____________________。(2分)
(3)写出反应①、②、④的化学方程式并指出反应类型
①_____________________________________________;_____________;
②_____________________________________________;_____________;
④_____________________________________________;_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A. 同质量、不同密度的N2和CO2 B. 同温度、同体积的H2和N2
C. 同体积、同密度的C2H4和C3H6 D. 同压强、同体积的N2O和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g)△H <0,
2NH3(g)△H <0,
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1) | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+ c(H+)= c(Cl-)+ c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:
![]()
![]()
则反应![]() 的
的![]() 。
。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使![]() 难放电、阳极电极不溶解)。写出电解总方程式 。
难放电、阳极电极不溶解)。写出电解总方程式 。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的电极发生 反应。(填“氧化”或“还原”)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是
A.1molC10H22分子中共价键总数为31NA个
B.0.1molCH4中含有NA个电子
C.标准状况下,22.4LCHCl3含有氯原子数目为3NA个
D.标准状况下,22.4L甲烷和乙烷混合气体中的分子数NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点 (填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
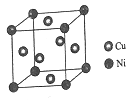
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
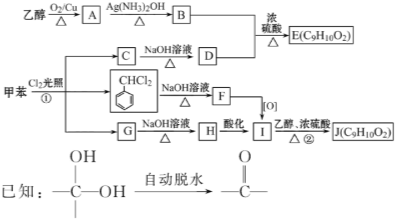
请回答:
(1)写出下列反应方程式
①B+D→E_____________________________。
②G→H_______________________________。
(2)①的反应类型为__________;②的反应类型为________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答) 。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
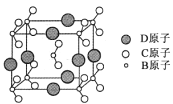
查看答案和解析>>
科目: 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)试写出SiCl4的电子式_____________________________。
(2)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的物质的量增加了0.02mol,则H2的平均反应速率为____________________。
(3)上述反应达到平衡后,下列说法正确的是__________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量平衡向左移动
d.其他条件不变,增大HCl的浓度平衡向左移动
(4)一定条件下,在恒容密闭的容器中,能表示上述反应达到化学平衡状态的是_____。
a.3v逆(N2)= v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
e.单位时间内有n molN2消耗的同时有6 molHCl生成
(5)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比_______m:n(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com