
科目: 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH3+) B.碳负离子(CH3—)
C.甲基(—CH3) D.碳烯 (︰CH2)
①四种微粒中,键角为120°的是 (填序号)。
②碳负离子(CH3—)的空间构型为 ,与CH3—互为等电子体的一种分子是 (填化学式)
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。请回答下列问题:
①C、N、O的电负性由大到小的顺序为 。
②写出Cu的核外电子排布式 。
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为 。
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为 ;1mol尿素分子中, σ 键的数目为 。
⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为a pm,则晶体的密度为___ g·cm—3。

查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
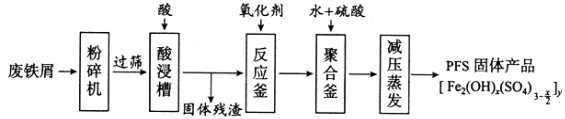
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B.![]() C.
C.![]() D.
D.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
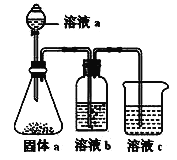
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为![]() 。
。
(1)苹果醋中含有的官能团的名称是________、_____________。
(2)苹果醋的分子式为__________________。
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气________L。
(4)苹果醋可能发生的反应是________。
A.与NaOH溶液反应 |
B.与石蕊溶液作用 |
C.与乙酸在一定条件下酯化 |
D.与乙醇在一定条件下酯化 |
查看答案和解析>>
科目: 来源: 题型:
【题目】分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A.煤液化制得清洁能源 B.人工固氮
C.将氯气通入冷的消石灰中制漂白粉 D.从海水中提取氯化镁
查看答案和解析>>
科目: 来源: 题型:
【题目】Al及Al的合金在生活生产中有着广泛的应用
(1)航母升降机可由铝合金制造。
①Al元素在周期表中的位置是 ;
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为: 。
(2)2015年11月首架C919大飞机总装下线,标志着我国跻身飞机研制先进国家行列。机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是 (填字母)。
a.密度大 b.硬度大 c.抗腐蚀
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO![]() 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。
利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:
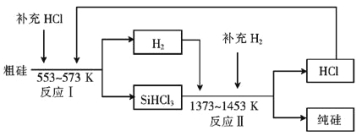
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com