
科目: 来源: 题型:
【题目】 化学与生活密切相关。下列说法正确的是( )
A. 福尔马林可作食品的保鲜剂
B. 乙烯可作水果的催熟剂
C. 做衣服的棉和麻均与淀粉互为同分异构体
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质的应用的说法正确的是
A.金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀
B.MgO的熔点很高,可用于制作耐高温材科
C.铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
D.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500~600℃的铁屑中通入氯气生产氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。

回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取 。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 。
(3)若操作不当,制得的FeCl2 会含有少量FeCl3 ,检验FeCl3常用的试剂是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
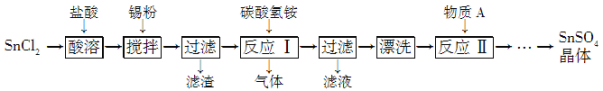
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )

A.腐蚀过程中,负极是c
B.正极反应是O2 + 4e-+2H2O=4OH-
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况)
D.环境中的Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能成功的是( )
A. 将乙酸和乙醇混合加热制乙酸乙酯
B. 苯和浓溴水反应制溴苯
C. 向浓苯酚中加几滴稀溴水观察沉淀
D. 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色。

请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是_____________;
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为___ _______;
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)_______c(NO3―)(选填“>”“=”或“<”)。
(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式 。
②A是重要的化工原料,工业上制取A的反应的化学方程式为___________。
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:_______ 。
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) ![]() x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
A. 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B. 平衡时,甲、乙两容器中A、B的物质的量之比相等
C. 平衡时,甲中A的体积分数为40%
D. 若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H=kJ·mol-1
N2(g) + 2CO2(g)的△H=kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
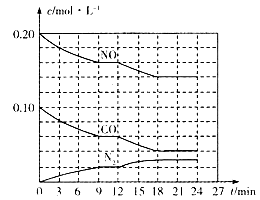
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度B.加入NO C.加催化剂D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
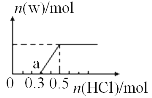
①O点溶液中所含溶质的化学式为;
②a点溶液中各离子溶度大小关系为______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com