
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: |
|
| |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
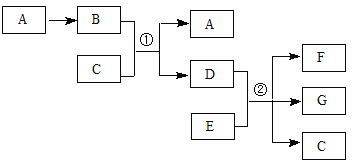
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学-选修2:化学与技术】(15分)
实验室用MnO2、KOH及KClO3原料制取高锰酸钾的实验流程如下:
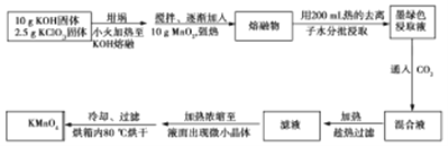
回答下列问题:
(1)实验中采用_______(填“铁坩埚”或“瓷坩埚”)加热KOH和KClO3固体混合物。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,该反应的化学方程式为__________。
(3)几种物质的溶解度曲线如图所示。
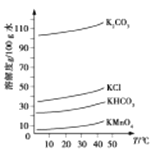
①通入CO2至pH为10~11, K2MnO4转化为KMnO4和MnO2,该反应的离子方程式为_________。
②不能通入过量CO2的原因是_____________。
(4)趁热过滤的目的是_________;用冷水洗涤KMnO4晶体较好的原因是_____________。
(5)计算经过上述转化,最多可制得KMnO4质量为________(结果保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学-选修5:有机化学基础】 (15分)
用于治疗精神疾病的药物半富马酸喹硫平的一仲合成路线如下所示:
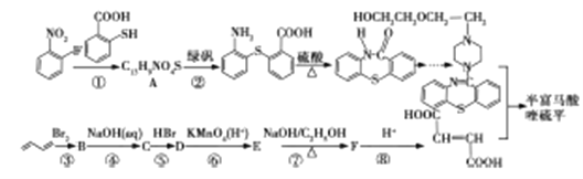
请回答下列问题:
(1)A中除硫醚键(-S-)外,还含有的官能团是______,反应③是l,3-丁二烯发生l,4-加成反应,则B的系统命名为___________。
(2)反应①~⑤中属于取代反应的有________(选填序号);流程中设计反应⑤和⑦的目的是___________________。
(3)写出反应⑦的化学方程式_____________。
(4)l,3-丁二烯分子中最多有_______个原子共平面,聚l,3-丁二烯的结构简式为__________。
(5)C的同分异构体有多种,符合下列条件的物质的结构简式为_________
① 能发生银镜反应;
② 能与NaoH溶液反应,与NaHCO3溶液不反应;
③ 核磁共振氢谱只有三组峰
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,下列溶液的pH值最小的是
A. 0.01mol·L-1HCl
B. pH=2的H2SO4溶液
C. c(OH)=10-13 mol·L-1
D. pH=1溶液加水稀释1倍
查看答案和解析>>
科目: 来源: 题型:
【题目】 某恒温密闭容器中,可逆反应A(s) ![]() B+C(g) ΔH=Q kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
B+C(g) ΔH=Q kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
A.产物B的状态可能为固态或液态
B.平衡时,单位时间内A和B消耗的物质的量之比为1:1
C.保持体积不变,向平衡体系中加入A(s),平衡不移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究。
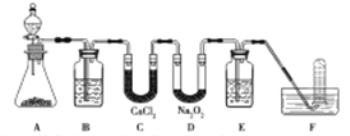
(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是________;装置B的作用是____________。
(2)检验F中气体成分,即能说明过氧化钠可作潜水艇供氧剂,则实验操作的方法及现象是_______________。
(3)查阅有关资料表明:2H2O+2Na2O2=4NaOH+O2↑。某研究小组用同位素标记法对过氧化钠进行标记(![]() ),以探究这一反应的历程:_________________
),以探究这一反应的历程:_________________
①甲同学从电子转移角度得出其离子方程式为:_______________。
②乙同学发现:向Na2O2与水反应后的溶液中加入MnO2,又产生无色能使带火星的木条复燃的气体,从这个角度,写出其反应历程:___________________。
(4)设计并完成过氧化钠样品(已知所含杂质与酸碱均不反应)的纯度测定:
甲、乙两位同学各取了ag样品并分别配制成了100.00mL溶液进行实验,实验操作中甲同学是将样品直接溶于蒸馏水中;而乙同学却是将蒸馏水先加热煮沸,再把蒸馏水分成两份,一份中趁热加入样品溶解,待冷却到室温后再加人另一份水来进行配制。他们分别取出各自配制的溶液20.00mL,加入酚酞数滴后,用浓度为cmol/L的盐酸进行滴定;重复滴定操作2次,甲同学和乙同学分别计算出了所用盐酸的体积平均值,分别为VAmL和VWmL。
①在样品的溶解与配制中,你认为_______(填“甲”、“乙”)同学的操作是合理的,理由是:__________________。
②另一同学的操作将会使实验结果______(填“偏大”、“偏小”或“无影响”)。
③原过氧化钠样品的纯度是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为_____ _。
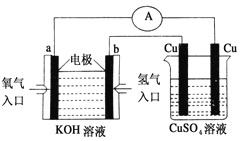
②如图装置中,某一铜电极的质量减轻3.2 g,则a极上消耗的O2在标准状况下的体积为____________L
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
反应速率与时间的关系如下图所示。
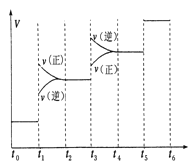
图中t1时引起平衡移动的条件可能是__________其中表示平衡混合物中NH3的含量最高的一段时间是_____
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应
后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若平衡体系A+B![]() C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
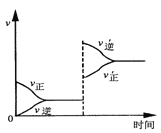
A.A、B、C、D都是气体
B.C、D都是气体,A、B中有一种是气体
C.A、B都不是气体,C、D中有一种是气体
D.A、B都是气体,C、D中有一种是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com