
科目: 来源: 题型:
【题目】(12分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2-2.9 | 2.8-3.1 | 22-28 | 60-65 | 1-2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50ml溶液,然后用0.05mol/L盐酸与它反应,得到图象如下(已知:1mol=1000mmol)
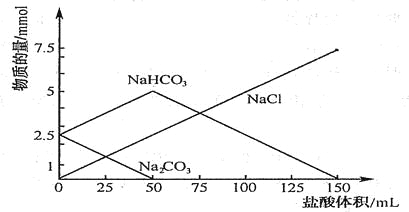
(1)盐酸加到25ml时溶液中发生反应的化学方程式 .
(2)原混合物中Na2CO3物质的量为 mol
(3)盐酸加到150ml时,放出标准状况下气体 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量的CO2分别通入①NA2SiO3溶液; ②CACl2溶液 ③CA(ClO)2溶液 ④饱和NA2CO3 溶液,最终溶液中有白色沉淀析出得是
A.①②③④ B.①④ C.①②③ D.②③
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n molA的同时生成2n mol D的状态
B 生成物浓度不再变化的状态
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJmol-1、-283.0 kJmol-1和-726.5 kJmol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
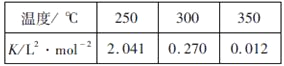
①由表中数据判断△H_______0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为________,则反应速率v(H2)=__________。
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
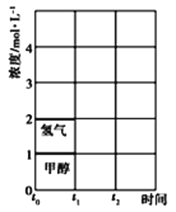
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。I.在具支试管中加入碎瓷片和无水硫酸铝,用注射器吸取一定量石蜡油,重新连接好装置;点燃酒精灯,加热具支试管中的碎瓷片和无水硫酸铝的混合物约两分钟;将注射器中的石蜡油缓慢、逐次推入具支试管中,石蜡油与灼热的碎瓷片和无水硫酸铝接触,将所得气体依次通入酸性高锰酸钾溶液和溴水中,发现酸性高锰酸钾溶液和溴水均褪色.,将导气管迅速替换成燃烧尖嘴,点燃气体,火焰明亮,有黑烟。

(1)碎瓷片和无水硫酸铝的作用是___________。
(2)通过本实验说明____________________。
II.实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100![]() 左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。

(3)A装置中发生反应的离子方程式为 ;
(4)实验时,先点燃A处的酒精灯,当D管处颜色变黄绿色时,再点燃D处的酒精灯,这样操作是为了 。
(5)B装置中应盛放的试剂名称为 ;
(6)F装置所起的作用是阻止空气中的水进入反应器,防止无水三氯化铁潮解和
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气与二氧化硫都有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合溶液中,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】100 mL 6 mol·L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠(固体) B.水 C.碳酸氢钠溶液 D.氨水
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)某探究小组以硫酸和铜为原料设计如下四种制备硫酸铜晶体的路线:

请回答下列有关问题:
(1)甲方案中第一步发生反应的化学方程式为___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用废铜、废酸(含HNO3、H2SO4)为主要原料制备硫酸铜晶体,某含有c(HNO3)=2molL-1,c(H2SO4)=4molL-1的废酸混合液100mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4 5H2O)的质量为___________。
(4)丙方案中灼烧时,应在________中进行(填仪器名称),该实验中的后续操作指的是____________。
(5)丁方案中X可以是试剂,也可以是反应条件:
①若X为试剂,该反应的化学方程式为__________________。
②若X为反应条件,即通电,在虚线框中画出该实验设计图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com