
科目: 来源: 题型:
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
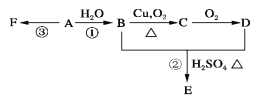
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:_____________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
____________________________________________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下表为4种常见溶液中溶质的质量分数和物质的量浓度:
溶 质 | HCl | NaOH | CH3COOH | HNO3 |
溶质的质量分数/% | 36.5 | 40 | 60 | 63 |
物质的量浓度/mol·L-1 | 11.8 | 14.3 | 10.6 | 13.8 |
这4种溶液中密度最小的是( )
A.HCl B.NaOH C.CH3COOH D.HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学基本概念的判别正确的是:( )
A.氧化还原反应的本质是元素化合价的升降
B.分散系分为溶液、胶体和浊液的依据:分散质微粒直径大小
C.某元素由化合态变为游离态,此元素一定被还原
D.强电解质与弱电解质:溶液的导电能力大小
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备制备氯气,化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。并对氯气的性质进行探究。
(1)氯气制备:

①欲收集一瓶干燥的氯气,请按接口序号完成“制取→收集”的连接顺序为:
→ c → d → → → i → j → k
②制备氯气也可用高锰酸钾固体和浓盐酸在常温下制得,其化学方程式为:
□KMnO4 + □HCl(浓) → □MnCl2 + □Cl2↑ + □KCl + □
请配平上述化学方程式。
③请写出仪器G中可能反应的离子方程式为
(2)性质检验:将氯气溶于水后,进行实验检测。所用试剂有:0.01mol/LAgNO3溶液、紫色石蕊试液。
操作步骤 | 实验现象 | 解释原因 |
① | 滴加 ,现象有: | 原因有: |
② | 滴加 ,现象有: | 原因有: |
查看答案和解析>>
科目: 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目: 来源: 题型:
【题目】在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )
A.1:1 B.2:1 C.3:2 D.4:1
查看答案和解析>>
科目: 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A、Ca2+、Na+、NO3-、CO32- B、Mg2+、C1-、NH4+、SO42-
C、K+、Cl-、HCO3-、NO3- D、Ca2+、Na+、Fe2+、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如下图所示,其中的过氧基(—O—O—)具有强氧化性。请回答下列问题:

①青蒿素的分子式为 ;
②下列有关青蒿素的叙述中,正确的是 填字母).
A.青蒿素属于芳香族化合物
B.青蒿素具有强氧化性,可用于杀菌
C.青蒿素分子中的所有碳原子在同一个平面上
D.在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸)![]() 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:

请回答下列问题:
①制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是 (填字母).
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
②写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式 ;
③1mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com