
科目: 来源: 题型:
【题目】某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。

请回答下列问题:
(1)各装置的正确连接顺序为(填写装置代号)A→______→_____→______→______。
(2)装置C的作用是_____________________;装置D的作用是_______________________;装置E的作用是_______________________。
(3)反应开始后,B中硬质玻璃管内的现象为______________________;可以检验生成物中含有Fe3+的试剂是____________(填写试剂名称)。
(4)A中发生反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)、室温下,将1.000mol/L盐酸滴入20.00mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。

(1)a点由水电离出的c(H+)=__________。
(2)d点溶液温度最高的原因是__________ 。
(II)电离常数是衡量弱电解质电离程度强弱的物理量。已知:化学式电离常数(25℃)HCN K=4.9×10-10,CH3COOH K=1.8×10-5,H2CO3 K1=4.3×10-7、K2=5.6×10-11,一氯乙酸K=1.4×10—3
(3)25℃时,有等浓度的:①NaCN溶液,②Na2CO3溶液,③CH3COONa溶液,三溶液的pH由大到小的顺序为________________________。(填序号)
(4)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________________。
(5)下图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是( )
A.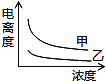 B.
B. C.
C. D.
D.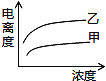
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成。下列说法正确的是( )

A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下AgCl在NaI溶液中开始转化为AgI则NaI的浓度必须不低于![]() ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,科学家、合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如下图所示。下列说法正确的是
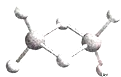
A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
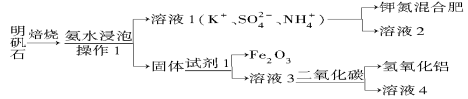
(1)操作1所用到的玻璃仪器的名称是 。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式: 。
(4)请你写出验证溶液1中有NH4+的实验过程: 。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
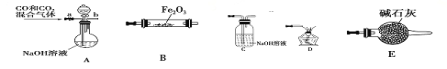
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②在点燃B处的酒精灯前,应进行的操作是____________。
③装置C的作用是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 酸性氧化物不一定都是非金属氧化物
B. HCl、H2S、NH3都是电解质
C. 强酸强碱都是离子化合物
D. FeBr3、FeCl2、CuS都不能直接用化合反应制备
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后。试回答下列问题:
2NH3(g)△H<0,达到平衡后。试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=____________。 达到平衡后,若其它条不变,升高体系的温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将_______(“增大”、“减小”或“不变”,下同)。 若再通入1mol N2和3mol H2,氮气的转化率将 。
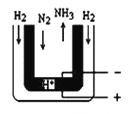
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 ;
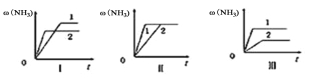
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com