
科目: 来源: 题型:
【题目】工业合成氨反应的化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
(1)2min 内H2的反应速率v(H2)= ;
(2)充分反应并达到平衡时,放出的热量 92.3kJ(填“大于”、“小于”或“等于”)。
原因是 。
(3)下列说法可证明反应达到平衡状态的 。
A.单位时间内,断开1mol N≡N,同时断开3mol H—H
B.单位时间内,形成1mol N≡N,同时形成3mol N—H
C.单位时间内,断开1mol N≡N,同时断开6mol N—H
D.单位时间内,形成1mol N≡N,同时断开3mol H—H
(4)氨的一个重要用途是用于制备火箭发射原料N2H4(肼),已知:火箭发射的原理是N2H4(肼)在NO2中燃烧,生成N2、水蒸气。根据如下反应:
N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534.0kJ/mol
写出在相同状态下,发射火箭反应的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸是一种重要的化合物,其结构简式为:![]() 。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
(1)用系统命名法命名乳酸___________________。
(2)乳酸发生消去反应所得产物的结构简式为______________________。
(3)1mol乳酸分别与足量的Na、Na2CO3、NaHCO3反应时,消耗三物质的物质的量之比为___________。
(4)乳酸在Cu或Ag作催化剂时会被氧气氧化,写出此反应的化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化H2S生成S是时,自身发生如下变化: IO3-→I2; Fe3+→Fe2 +; SO2→S;MnO4-→Mn2+ 。如果分别用等物质的量的这些物质氧化足量的H2S,得到S最多的是( )
A.IO3- B.Fe3+ C.SO2 D. MnO4-
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)______________。
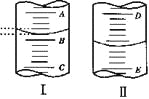
a.是amL b.是(50-a)mL
c.一定大于amL d.一定大于(50-a)mL
(3)如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图。

请指出A、B、C、D分别与①②③④相匹配的可能组合:
A与 ; B与 ;
C与 ; D与 。
(4) 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。
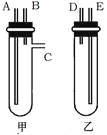
步骤如下:
①将锌粒放于 (填“甲”或“乙”,下同)装置中,将稀硫酸放于 装置中。
②用橡胶管连接对应接口(填编号):A接 ,B接 。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I.分子式的确定:
(1)将一定量有机物A置于氧气流中充分燃烧,实验测得:生成3.6g H2O和8.8g CO2,消耗氧气5.6L(标准状况下),则该物质中各元素的原子个数比是_______________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,由此确定该物质的分子式是______________。
(3)根据价键理论,预测A的可能结构有________种。
II.结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为_________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】I.以下是元素周期表的一部分,根据图示回答下列问题:
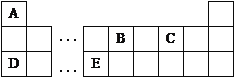
(1)将16.25gFeCl3投入足量A2C2溶液中,产生大量气泡,反应完全后,FeCl3的质量为__________g。
(2)1.3gB2A2气体完全燃烧,恢复至室温,放出65kJ热量,写出代表B2A2燃烧热的热化学反应方程式_____________________________________________________________。
(3)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为:
_____________________________________________________________。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的外围电子排布式为3d64s2,W的价层电子排布式为ndn+5(n+1)sn-1。
(4)X在元素周期表中的位置___________________________;W元素的名称为_________。
(5)XY2分子中各原子均满足8电子稳定结构,画出XY2的电子式____________。
(6)电负性X_______Y;Z的原子结构示意图为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
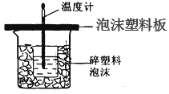
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________;由图可知该装置有不妥之处,应如何改正? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会______________(填“相等”或 “不相等”),理由是_____________________________。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
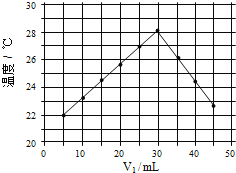
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com