
科目: 来源: 题型:
【题目】Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
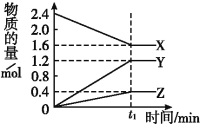
(1)该反应的化学方程式是 。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+2SO32-→I-+2SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)
④I2+SO32-+H2O→2I-+SO42-+2 H+(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。(填“①、②、③、④”)。
(2)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,才会使淀粉变蓝的现象产生。
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年8月12日23:30左右,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)和金属钠等危险化学品。
(1)钠在周期表中的位置是 ,实验室少量的钠保存于 中。
(2)NaCN的电子式是 。
(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡。氰化钠易溶于水,水溶液呈强碱性。氰化钠泄露可用双氧水或硫代硫酸钠中和。
①用离子方程式表示其水溶液呈强碱性的原因: 。
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的离子方程式 ;
③用硫代硫酸钠中和的离子方程式为:CN-+S2O32- = A+SO32-,A为 (填化学式)。
④可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论): 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.烧碱、冰醋酸、四氯化碳均为电解质
B.胆矾、冰水混合物、四氧化三铁都不是混合物
C.分离胶体和某盐溶液,可用过滤的方法
D.SO2、SiO2、CO均为酸性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
![]() MnO2 +
MnO2 +![]() Fe2++
Fe2++![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
A. 提出了原子学说 B. 提出了元素周期律
C. 提出了分子学说 D. 制定了科学的元素周期表
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法正确的是
A.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
B.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硅和硅的化合物性质的叙述,正确的是( )
A.二氧化硅溶于水可制得硅酸
B.二氧化硅是酸性氧化物,不跟任何酸起反应
C.硅酸的酸性比碳酸弱
D.硅在常温下能跟氢气起反应生成SiH4
查看答案和解析>>
科目: 来源: 题型:
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com