
科目: 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
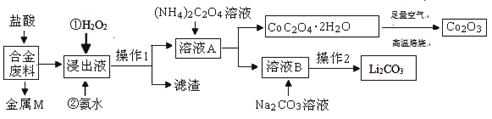
(1)金属M为__________。
(2)加入H2O2的作用是(用离子方程式表示)____________,加入氨水的作用是________。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为__________________________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是___________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。

(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B,打开开关A,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
i滴定过程中发生反应的离子方程式为
ii滴定终点的现象是
iii通过实验数据计算的该产品纯度为 (用字母a,c表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
![]()
(1)写出元素符号:A ;B ;C 。
(2)C的原子结构示意图: ;B的最高价氧化物对应水化物的化学式为 。
(3)A的氢化物的水溶液显 (填“酸”或“碱”)性。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等。
(1)以N2 和H2 为原料合成氢气为: N2(g) + 3 H2(g) ![]() 2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
(2)将体积均为560 mL(标准状况下)的SO2 和Cl2 同时缓慢通A水中,得到1.0 L溶液,则溶液pH=_______。
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3 溶液中,阴离子的电离程度较小的是__________(填化学式),原因是___________ 。
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是___________(填化学式,下同),阳极区放出的混合气体的成分为___________。
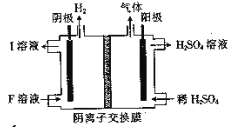
(5)氨水是一种常见的沉淀剂。向1.0 L 2.0×10—4molL—1的MgCl2 溶液中通入(不考虑溶液体积的变化),有白色沉淀生成。
①写出生成白色沉淀的离子方程式____________________.
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为___________mL。
(已知实验条件下NH3.H2O的电离平衡常数为1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
查看答案和解析>>
科目: 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a molA,同时生成3a molB
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
⑨混合气体的平均相对分子质量不再改变
A.②⑧ B.④⑦ C.①③ D.⑤⑥
查看答案和解析>>
科目: 来源: 题型:
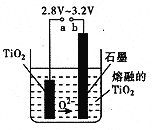
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
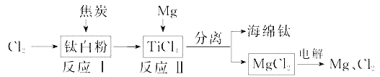
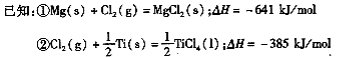
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 ;
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为: ;
(3)反应Ⅱ的热化学方程式为 ;
(4)该工艺流程中,可以循环使用的物质有 ;
(5)在800 ~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com