
科目: 来源: 题型:
【题目】(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为______
(2)用一个甲基,一个乙基、一个—C3H7分别取代苯环上的氢原子,所得的三取代物有 种。
(3)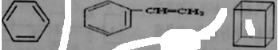 组成的混合物中碳的质量分数为 。
组成的混合物中碳的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
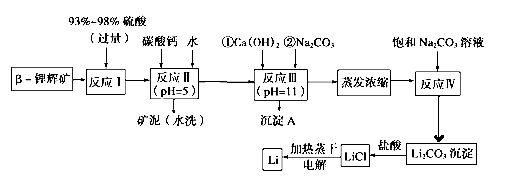
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中含有苯酚,实验操作是___________________________________________________。从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚。试写出②、③步的化学方程式__________。
(2)某醛的结构简式为 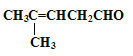
检验分子中醛基的所用的试剂是________________,化学方程式为____________;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是____________;
(3)做过银镜反应的试管内壁的一层银,可用_________除去。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A.石油的分馏可得到汽油
B.石油分馏得到的重油经过催化裂化可以得到汽油
C.汽油是烃的混合物,煤油、柴油是由烃构成的纯净物
D.石油裂解是为了获得更多化工原料,如乙烯、丙烯等
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则As2S3和浓HNO3反应的方程式是
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS、S2的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
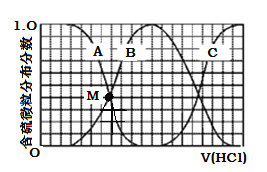
①曲线B表示 的分布分数。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
A.c(Na+)= c(HS)+2c(S2)
B.3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C.3c(Na+)=[c(H2S)+c(HS)+c(S2)]
③NaHS溶液呈碱性,当滴加盐酸至M点(A、B曲线的交叉点)时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
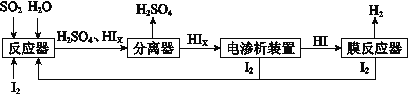
①写出反应器中发生反应的化学方程式是 。
②电渗析装置如下图所示
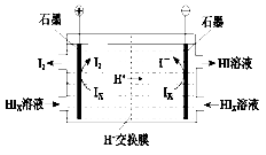
写出阳极的电极反应式 。
该装置中发生的总反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】〔化学——选修4:物质结构与性质〕
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图_ ,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式 。
Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示
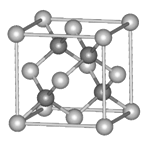
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为 。
(4)AsH3空间构型为 。已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是______________________。
(5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏伽德罗常数值为NA,则砷化镓晶体密度表达式是 g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸 B.将HCl通入NaAlO2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液 D.加热溶有SO2的品红溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列性质递变规律错误的是
A. 金属性:K>Na>Li
B. 酸性:HClO3>H2SO4>H3PO4
C. 还原性:I->Br->Cl-
D. 氧化性:F2>Cl2>Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子等于其电子层数;B元素基态原子有三个能级电子数相同;A和D可形成两种常见液态化合物甲、乙,其原子数之比分别为1:1,2:1;E元素原子的K、L层电子数之和等于其M、N层电子数之和。回答下列问题(涉及元素用相应化学符号表示):
(1)B、C、D三种元素中电负性最大的元素其基态原子的电子排布式为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
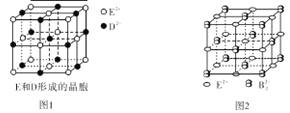
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有 个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,焰色反应的原理是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为_______________;该化合物的化学式为 。
(4)用高能射线照射液态化合物乙时,一个乙分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干乙分子形成的“网”捕获,乙分子间能形成“网”的原因是 。
②由乙分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
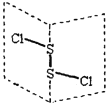
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com