
科目: 来源: 题型:
【题目】随着卤素的原子半径的增大,下列递变规律正确的是( )
A. 单质的熔点逐渐降低 B. 卤素离子还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质氧化性逐渐增强
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)分析如图所示的三个装置,回答下列问题:

①装置a中铝电极上的电极反应式为________________________。
②装置b中产生气泡的电极为________电极(填“铁”或“铜”),装置c中铜电极上的电极反应式为_____________________________________。
燃料电池是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲烷、肼等。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为:__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(3)肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的负极电极反应式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)

查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
![]()
1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
A.中心原子的价层电子对数目相等 |
B.都是极性分子 |
C.中心原子的孤对电子数目相等 |
D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3
查看答案和解析>>
科目: 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
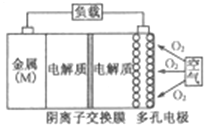
A.比较Mg、Al、Zn三种金属–空气电池,Mg–空气电池的理论比能量最高
B.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
C.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用酸性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A—)+c(HA)
D.b点所示溶液中c(A—)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2。
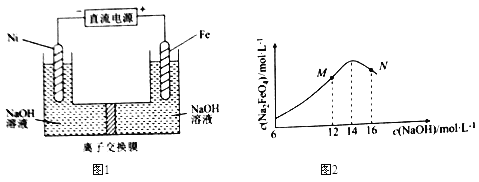
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )
A.制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O
B.电解过程中,须将阴极产生的气体及时排出
C.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
D.图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com