
科目: 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
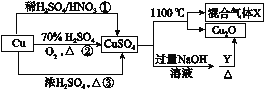
A.途径①所用的混酸中H2SO4与HNO3的物质的量之比最好为3∶2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1 mol CuSO4在1100 ℃所得混合气体X中O2一定为0.75 mol
D.Y可以是葡萄糖溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
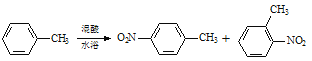
实验中可能用到的数据:
密度/gcm-3 | 沸点/ ℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
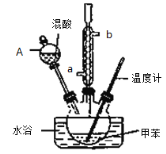
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许 ,目的是 。
(2)冷凝管的作用是 ;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是 ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为 ,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和 、 。
(5)该实验中一硝基甲苯的产率为 (保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为
![]()
下列说法中不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯的一氯取代物有3种
C. 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2
D. 对三联苯分子中至少有16个原子共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】“共建生态文明,共享绿色未来”。下列做法不符合这一主题的是( )
A.将绿色化学应用于化工生产中
B.综合利用化石燃料
C.以可降解餐具代替耐用型餐具
D.选择合适的“低碳”的出行方式
查看答案和解析>>
科目: 来源: 题型:
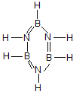
【题目】试回答下列问题:
(1)已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似(如图),则硼氮苯的二氯代物的同分异构体的数目为________种。
(2)氟烷的麻醉作用比吗啡强100倍。已知氟烷的分子式为C2HClBrF3,则氟烷的同分异构体(不考虑手性异构)有________种。
(3)萘的分子式为C10H8,结构简式可以表示为![]() 。萘的一氯代物有________种可能的结构,萘的六氯代物有________种可能的结构。
。萘的一氯代物有________种可能的结构,萘的六氯代物有________种可能的结构。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下将足量的炭和2 mol水蒸气混合于1 L的密闭容器中,发生如下反应:C(s)+H2O(g) ![]() CO(g)+H2(g),
CO(g)+H2(g),
(1)该反应平衡常数K的表达式
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,1000 ℃时,该反应的平衡常数K2为1.0,则该反应为的ΔH (填“<0”或“>0”)。
(3)能判断该反应达到化学平衡状态的依据是________。(填编号)
A、容器中气体的密度不变
B、生成a mol CO的同时消耗a mol H2
C、c(H2O)=c(CO)
D、混合气体的平均相对分子质量不变
(4)在1 000 ℃下,某时刻CO的物质的量为1.0 mol,则此时v正________v逆(填“>”、“=”或“<”),此时H2O(g)的转化率为________
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=____________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ
C.增大压强或升高温度,该反应过程都能放出更多的热量
D.2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
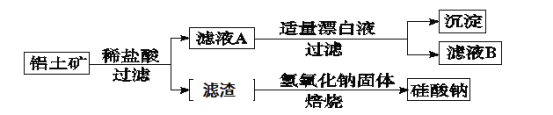
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
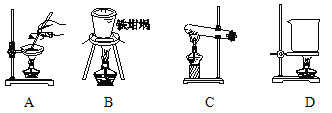
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com