
科目: 来源: 题型:
【题目】下列化学应用中不涉及氧化还原反应的是
A. Na2S水溶液在空气中变浑浊
B. 生活中使用明矾净水,除去水中的悬浮颗粒
C. 溶有二氧化氮的浓硝酸做火箭的助燃剂
D. 漂白粉漂白有色布条
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在溶液中能大量共存,加入 Fe2(SO4)3 后仍能大量共存的是
A.Na+、I-、CO32-、ClO-
B.Fe2+、H+、K+、NO3-
C. Ba2+、Na+、SCN-、Cl-
D.Cu2+、Mg2+、Cl-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】I、关于工业转化图(见下图):
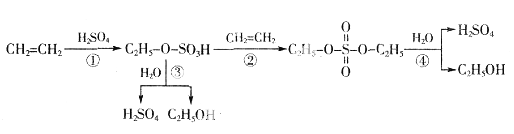
1、①反应类型: ④反应类型: 。
2、实验室制备乙烯的反应条件是 ;反应温度过低会产生副产物: (写结构简式);
II、现拟分离混有乙醇、乙酸和水的乙酸乙酯粗产品,下图是分离操作步骤的流程图,试填写图中试剂的化学式及分离方法
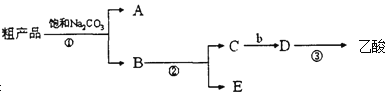
(1)试剂b是 ;
(2)分离方法①是: ;分离方法②是: ;
(3)A是: ;
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
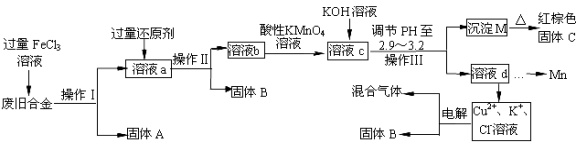
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)① 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
② 若用X mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为m g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L。(用含m的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:

(1)降低温度,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____ _____。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目: 来源: 题型:
【题目】氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Al(s)+2O3(g)===2Al2O3(s) ΔH2
3O2(g)===2O3(g) ΔH3则( )
A.ΔH1-ΔH2=ΔH3
B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3
D.ΔH2+ΔH1+ΔH3=0
查看答案和解析>>
科目: 来源: 题型:
【题目】1)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因 .
2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
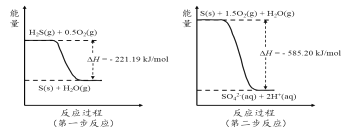
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________(“从A到B”或“从B到A”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式2H2(g)+O2(g)===2H2O(l) ΔH1<0,则关于2H2O(l)===2H2(g)+O2(g) ΔH2的说法不正确的是( )
A.热化学方程式中的化学计量数只表示分子数
B.该反应的ΔH2应大于零
C.该反应的ΔH2=-ΔH1
D.该反应可表示36 g液态水完全分解生成气态氢气和氧气的热效应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网
B. 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水
C. 配制1 mol·L-1 NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒
D. 量取25.00ml某盐酸,可以用量筒或者酸式滴定管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com