
科目: 来源: 题型:
【题目】在溶液中能大量共存的一组离子或分子是
A.NH、H+、NO、HCO
B.Na+、CH3COO-、CO、OH-
C.Na+、K+、SO、Cl2
D.K+、Al3+、SO、NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应方程式是 。
(3)下图是一个电化学过程示意图。
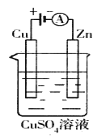
① 锌片上发生的电极反应方程式是 。
② 假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(5)将0.3 mol AgNO3、0.4 mol Cu(NO3)2和0.1mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,当阴极生成0.1mol气体时,此时,另一极上的气体体积(标准状况)为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
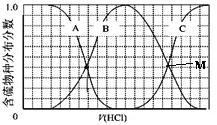
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
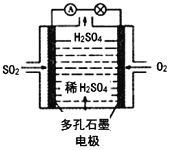
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2molL-1,则c(Cu2+)= _________ molL-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用铜制备CuSO 4 溶液有多种方案,某实验小组给出了以下三种方案:
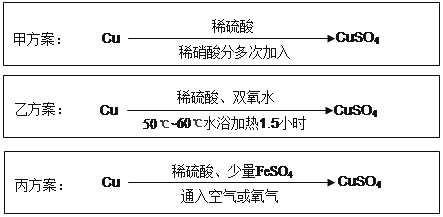
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H 2 SO 4 ):n(HNO 3 )= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L -1 的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO 4·5H 2O 20.0g【已知有关摩尔质量:M(Cu)=64g/mol, M(CuSO4·5H 2 O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H 2 O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO 4 ,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO
B.NaOH
C.CuCO 3
D.Cu 2(OH)2CO 3
E.Fe2(SO4) 3
②反应中加入少量FeSO 4 可加速铜的氧化,FeSO 4 的作用是 ;
反应过程中的的离子方程式为: 、
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。
查看答案和解析>>
科目: 来源: 题型:
【题目】试推测第 82 号元素 X 的单质及其化合物不可能具有的性质:
A. X 的氧化物的水化物可能有两种
B. 单质是能导电的固体
C. 单质不能与氢气直接化合
D. X 是非金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)Y在周期表中的位置是 。
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同): > > > ;比较Y、Z的气态氢化物稳定性强弱: > 。
(5)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为: 。
(6)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,写出该反应的热化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物在空气中燃烧的说法正确的是( )
A. 只有碳的氧化物和水
B. 只有CO2和水
C. 可能有碳的氧化物、水及其他元素的化合物
D. 有CO、CO2、水及其他元素的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:

实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com