
科目: 来源: 题型:
【题目】(1)在100 mL 0.8mol/L硝酸溶液中加入足量铜粉,则被溶解的铜的质量为____________g。
(2)在上述溶液中再加入足量稀硫酸,又有_______g铜溶解。此过程中生成的气体在标准状况下的体积为_________L。
(3)若向100 mL 0.8mol/L硝酸溶液中加入铁粉,测得反应后的溶液中Fe2+与Fe3+的浓度之比为1:1,则加入铁的质量为____________g。
(4)向100 mL 0.8mol/L硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出气体224mL(标准状况下),且测得溶液中铁元素只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1mol/L的NaOH溶液___________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
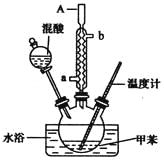
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
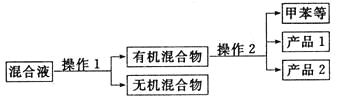
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.
查看答案和解析>>
科目: 来源: 题型:
【题目】物质发生化学反应时:①电子总数;②质子总数;③物质的结构;④分子总数;⑤物质所具有的总能量;⑥物质的总质量。反应前后肯定发生变化的是( )
A.①② B.⑤⑥ C.④⑥ D.③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置图进行实验.

根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_____________________________________.
(2)装置乙中正极的电极反应式是____________________________________..
(3)四种金属活泼性由强到弱的顺序是__________________________________.
(4)A、C形成合金,露置在潮湿空气中,_______先被腐蚀。
查看答案和解析>>
科目: 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)===
O2(g)===![]() N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成分是SiO2
D.电解熔融MgCl2,可制得金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A. 苯能使酸性高锰酸钾溶液褪色
B. 苯分子具有平面正六边形结构,12个原子在同一平面上,对位上的4个原子在一条直线上
C. 苯能使溴水褪色,是发生了取代反应
D. 苯不含有碳碳双键故不能发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应:2H2S+O2=2S↓+2H2O,Na2S+I2=2NaI+S↓
4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,下列物质的氧化性强弱判断正确的是
A.H2O>NaI>H2S B.H2S>NaI>H2O C.S>I2>O2 D.O2>I2>S
查看答案和解析>>
科目: 来源: 题型:
【题目】图中的实验装置可用于制取乙炔。请填空:


(1)图中,A管的作用是 。制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 , 乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com