
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大,逆反应速率不变。
C.反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
B.19g的H3O+ 离子中含有的电子数为11NA
C.0.5mol/LH2SO4中的H+数为NA
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是( )
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质和用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.CO具有还原性,可用于冶炼铁等金属
C.SiO2熔点高,可用作光导纤维
D.Al2O3具有两性,可用作耐高温材料
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是石墨电极。
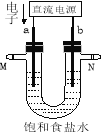
(1)a电极的名称 。
(2)电解过程中a极区域观察到的现象 。
(3)电解的总反应离子方程式为 。
(4)某实验小组用1.6A电流电解6.02min,在阴极可以生成 mL(标准状况)气体(一个电子的电量为 1.6×10-19C)。
(5)若将b电极换成铁作电极,电解一段时间后U型管底部出现红褐色沉淀,请用化学方程式解释这一现象,写出总反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
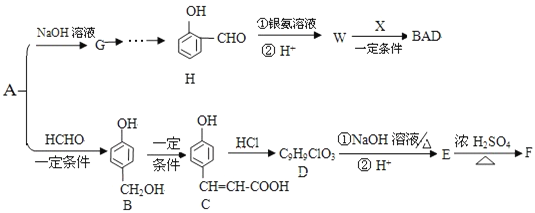
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:
已知:BAD的结构简式为: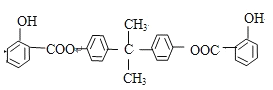
F的结构简式为: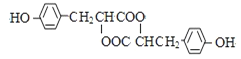
试回答:
(1)H中含有的官能团名称是 .
(2)写出X的结构简式 ,推测B的核磁共振氢谱中显示有 种不同化学环境的氢原子.
(3)写出反应类型 C→D ;E→F .
(4)1mol C与浓溴水反应,最多可以消耗 molBr2.
(5)C→D的过程中可能有另一种产物C1,请写出C1在加热条件下与足量稀NaOH水溶液
反应的化学方程式: .
(6)W的同分异构体有下列性质:与FeCl3反应,溶液呈紫色;能发生银镜反应;则该同
分异构体共有 种.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
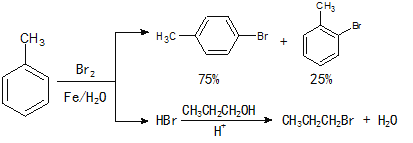
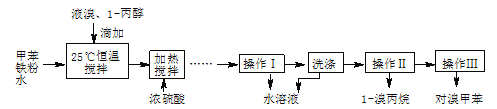
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:
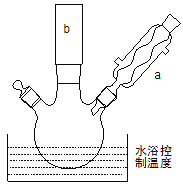
①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
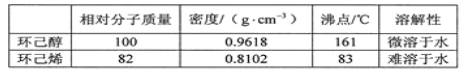
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.蒸馏烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如下表所示:
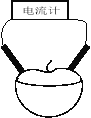
已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/A |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域c(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com