
科目: 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA
B.含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间
C.在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA
D.5NH4NO3![]() 4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
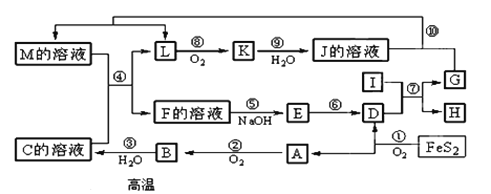
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第____________周期_________族。
(2) 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
(4) 反应④的离子方程式是:__________________________________。
(5) 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾), 同时还生成KNO2和H2O。该反应的化学方程式是:
_________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在AlCl3和FeCl3混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe(OH)3、Al(OH)3
B.Al(OH)3、I2
C.Fe2S3、I2
D.FeS、S、Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
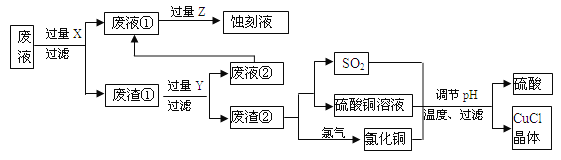
按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某补血剂样品【主要成分是硫酸亚铁晶体(FeSO4·7H2O)】中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用标准酸性KMnO4溶液滴定以测定铁元素的含量
⑴ 写出滴定反应的离子方程式 。
⑵ 下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
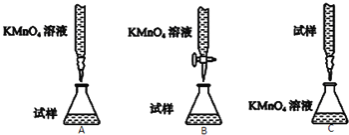
⑶ 实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称)
方案二:将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
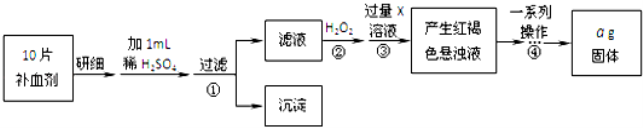
⑷ 步骤②中除用H2O2外还可以使用的物质是 。
⑸ 步骤②是否可以省略 ,理由是 。
⑹ 步骤④中一系列操作依次是:过滤、 、 、冷却、称量。
⑺ 假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是 ( )
A.OH-+CO32-+2H+![]() HCO3-+H2O
HCO3-+H2O
B.2OH-+CO32-+3H+![]() HCO3-+2H2O
HCO3-+2H2O
C.2OH-+CO32-+4H+![]() CO2↑+3H2O
CO2↑+3H2O
D.OH-+CO32-+3H+![]() CO2↑+2H2O
CO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①__________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
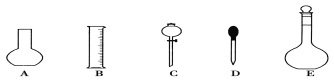
(2)根据计算用托盘天平称取NaOH的质量为③ g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__⑤__mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用__⑥__mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去):

试回答:
(l)写出B在工业生产中的一种用途:__________________,用化学方程式表示A物质在工业生产中的一种用途:__________________。
(2)写出B转化为C的可能的离子方程式____________;_____________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理___________________。
(4)若C为钠盐,用含m mol C的溶液与1Lnmol/L的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为__________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
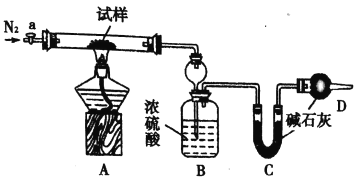
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:________________;_______________。
(2)装置B的作用为_______________。装置C的作用为_______________。
(3)实验过程中通入N2的目的为__________。
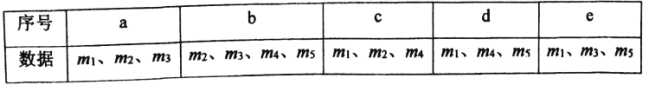
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是_______(填选项字母)
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:____________(若不能,此问不作答。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com