
科目: 来源: 题型:
【题目】下列说法正确的是
A. 石油裂解为乙烯属于取代反应
B. 乙酸分子中含有碳氧双键,所以它能使溴水褪色
C. 蛋白质在一定条件下发生水解反应生成葡萄糖
D. C4H10进行一氯取代后生成四种沸点不同的产物
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是 ( )

A. 沉淀乙一定有BaCO3,可能有BaSO4
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子
D.生成的甲、乙、丙气体均为无色的易溶于水气体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g),将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
SO3(g)+NO(g),将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
A.混合气体颜色保持不变 B.SO3和NO的物质的量的比保持不变
C.体系压强保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
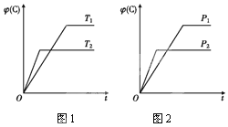
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的( )
A.已知C(s)+O2(g)═CO2(g)△H1;C(s)+![]() O2(g)═CO (g)△H2,则△H1>△H22
O2(g)═CO (g)△H2,则△H1>△H22
B.在稀溶液中,H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3kJmol﹣1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ
C.由C(石墨)═C(金刚石);△H=+1.90kJmol﹣1可知,金刚石比石墨稳定
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g)═2H2O(l);△H=﹣285.8kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g) △H<0,体系中,n(NO)随时间的变化如右表:
2NO2(g) △H<0,体系中,n(NO)随时间的变化如右表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是( )
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)右图中表示NO2的变化的曲线是________,
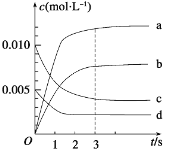
(3)用O2的浓度变化表示从0~2 s内该反应的平均速率v=____________。
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.将容器体积变为1L b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。【已知完全沉淀的pH:Ca(OH)2:pH ≥ 13;Al(OH)3:pH ≥ 5.5;Fe(OH)3:pH ≥ 4.1】
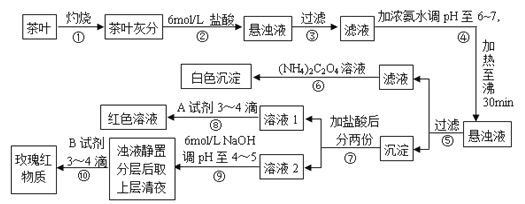
下列说法不正确的是( )
A.步骤②加入6mol/L盐酸的主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物
B.步骤⑤所得滤液中溶质的主要成分为:CaCl2、NH3·H2O
C.步骤⑥可以检出钙元素存在,离子反应方程式为Ca2++C2O42- = CaC2O4↓
D.步骤⑧中A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN- ![]() Fe(SCN)3
Fe(SCN)3
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
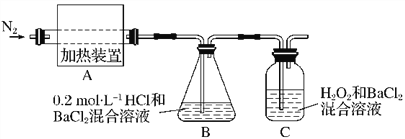
① A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________(填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________(用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO![]() +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com