
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.检验Cl-的试剂是硝酸银和硝酸
B.检验SO42-的试剂是氯化钡和盐酸
C.检验CO32-的试剂是盐酸、澄清石灰水和氯化钙
D.向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
A. 使石蕊试液变红
B. 与铜反应放出NO气体,生成Cu(NO3)2
C. 与Na2CO3反应放出CO2气体,生成NaNO3
D. 与S单质混合共热时生成H2SO4和NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NOx经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:

(1) T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的△H= kJ·mol-1。
3NO2(g)的△H= kJ·mol-1。
(2) T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
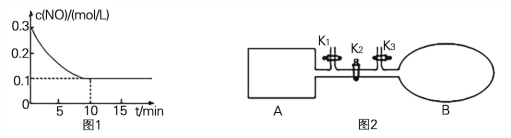
① T℃时,反应3NO(g) +O3 (g) ![]() 3NO2 (g)的平衡常数K= 。
3NO2 (g)的平衡常数K= 。
② 不能说明反应达到平衡状态的是 (填写字母)。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3) 如图2所示,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
① 容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)= 。
② 平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”、“变小”或“不变”) 。
③ 在②平衡后,打开K2,重新到达新平衡,B气囊的体积为0.8aL,则在打开K2之前,气囊B的体积为 L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:
实验步骤为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为B g;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为D g。
(1)坩埚中发生反应的化学方程式 。
(2)计算Na2CO3质量分数必须用到的测定数据为 。
乙方案:
在天平上准确称取 0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mol·L-1的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3,即HCl+Na2CO3 == NaHCO3+NaCl。重复上述操作两次。
(3)配制上述盐酸标准溶液100ml,若用2.0mol/LHCl进行配制,需用量筒量取该HCl溶液 ml;定容时俯视刻度线,将导致配制的溶液浓度 。(填“偏高”、“偏低”或“没有影响”)
(4)根据下表数据,样品中w(Na2CO3)= 。(用百分数表示,保留一位小数)
滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 0.3000 | 1.02 | 21.03 |
2 | 0.3000 | 2.00 | 21.99 |
3 | 0.3000 | 0.20 | 20.20 |
丙方案:
称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
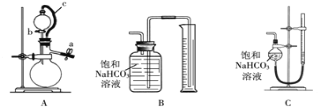
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气? (填“漏气”、“不漏气”或“无法确定”)。实验时,装置A中c的作用 , 。
(6)为了提高测定的准确性,应选用装置A和 (填写字母标号)进行实验。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业上制取硝酸的主要流程图如下图1:

(1)工业合成氨的原料是N2和H2。装置A的名称是 ;其中N2可从空气中分离出来,方法是先将空气 ,然后 即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为 。
(2)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
Ⅱ.利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如上图2。已知NO和NO2按1:1通入碱液中生成亚硝酸盐。
(1)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
(2)该工艺需控制NO 和NO2 物质的量之比接近1:1。若n(NO):n(NO2)>1:1,则会导致 ;若n(NO):n(NO2)<1:1,则会导致 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5物质结构与性质]
硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)基态铁原子的外围电子层排布为 ,该元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4, B原子的杂化方式为 。
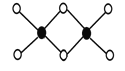
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“不是”)平面型分子。
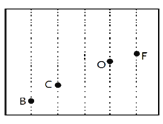
(4)依据第二周期元素第一电离能的变化规律,参照图中B、C、O、F元素的位置,用小黑点表示N元素的相对位置。
(5)Al单质为面心立方晶体,其晶体参数a=0.405nm,列式表示Al单质的密度: g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应与Na2O2+SO2![]() Na2SO4相比较,Na2O2的作用相同的是()
Na2SO4相比较,Na2O2的作用相同的是()
A. 2Na2O2+2CO2![]() Na2CO3+O2 B. 2Na2O2+2SO3
Na2CO3+O2 B. 2Na2O2+2SO3![]() 2Na2SO4+O2
2Na2SO4+O2
C. 2Na2O2+H2SO4![]() Na2SO4+H2O2 D. 3Na2O2+Cr2O3
Na2SO4+H2O2 D. 3Na2O2+Cr2O3![]() 2Na2CrO4+Na2O
2Na2CrO4+Na2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充.请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为 mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)定容时俯视刻度线,会使所配溶液浓度 (填“偏大”、“偏小”或“无影响”).
(5)进行操作C前还需注意 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时活塞位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。

请回答下列问题:
(1)甲室中气体的质量为 。
(2)甲室中HCl、N2的物质的量之比为__________。
(3)将隔板a去掉,当HCl与NH3充分反应生成NH4Cl固体后(仅发生此反应),隔板b将位于刻度“______”处(填数字,不考虑固体物质产生的压强),此时体系的平均摩尔质量_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com