
科目: 来源: 题型:
【题目】在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
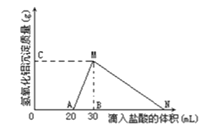
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
查看答案和解析>>
科目: 来源: 题型:
【题目】根据描述写出正确的化学方程式或离子方程式
(1)工业制取漂白粉_________________________________
(2)实验室制取氯气____________________________
(3)往碳酸氢钠溶液中滴加少量的氢氧化钙溶液_________________________
(4)向硫酸氢钠溶液中滴加氢氧化钡溶液至溶液呈中性___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关NaClO和NaCl混合溶液的叙述错误的是( )
A.该溶液可做杀菌消毒剂和漂白剂
B.该溶液中,OH—、K+、SO42—、NO3—可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+==Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
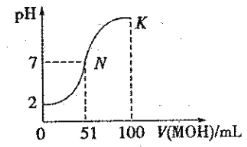
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体.它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为 (填化学式);
(2)1mol乙和足量甲反应可生成 mol B物质;1mol丙和足量甲反应可生成 mol B物质;
(3)D能使湿润的有色布条褪色,其褪色原因是 (结合化学反应方程式描述原因);
(4)丙与溶液F反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
离子 | Fe3+ | Fe2 + | Cu2+ |
开始沉淀pH | 1.9 | 7.0 | 6.7 |
沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是
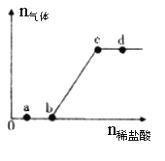
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了图1所示的实验装置。
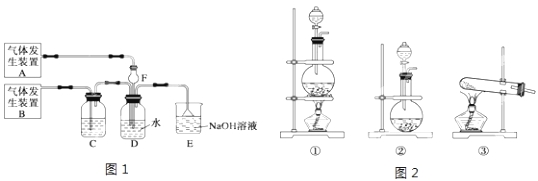
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。请写出制取Cl2的离子方程式: 。
(2)在此实验中,F仪器的作用是:______________;发生装置B应选择图2三种装置中的___________(填序号)。
(3)D装置中主要反应的离子方程式为 。
(4)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰酸钾溶液 ④品红溶液 ⑤溴水 ⑥稀硝酸
A.若Cl2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: ;(试剂可以多选,请填试剂的序号,下同)。
B.若SO2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com