
科目: 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A. 沼气是可再生资源,电能是二次能源
B. 对“地沟油”进行蒸馏即可得到汽油
C. 用焦炭还原铝土矿即可获得金属铝
D. 从海水提取物质都必须通过化学反应方可实现
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Na被完全氧化生成Na2O2,失去2NA个电子
B.常温常压下,18 g H2O 中含有的原子总数为3NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
D.1 mol Cl2与1 mol Fe反应,转移的电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式 。
(2)已知:
甲醇脱水反应 2CH3OH(g)═CH3OCH3(g) + H2O(g)△H1=﹣23.9kJmol﹣1
甲醇制烯烃反应 2CH3OH(g)═C2H4(g) + 2H2O(g)△H2=﹣29.1kJmol﹣1
乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=" +" 50.7kJmol﹣1
则乙烯气相直接水合反应C2H4(g) + H2O(g)═C2H5OH(g)的△H= kJmol﹣1,与间接水合法相比,气相直接水合法的优点是 ;
(3)气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中![]() :
:![]() =1:1)
=1:1)
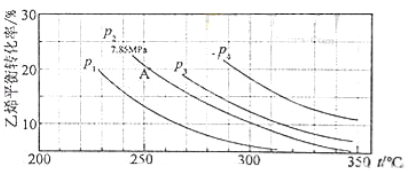
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= 。
(A点总压为7.85MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ;
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,![]() :
:![]() =0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
=0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质结构的说法正确的是
A.78g Na2O2晶体中所含阴、阳离子个数共为4NA
B.HBr的电子式为![]()
C.3.4g氨气中含有0.6NA个N——H键
D.PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】学习和研究化学,经常要进行实验,下列关于实验安全的说法正确的是

A. 用燃着的酒精灯去点燃另一只酒精灯,若酒精灯不慎着火,应立即吹熄
B. 不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗
C. 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
D. 盛放盐酸的试剂瓶上要贴上如下图的标志
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某同学用500 mL容量瓶配制0.10 mol·L-1Na2CO3溶液的步骤:
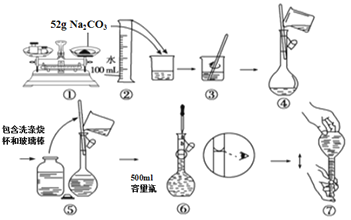
该同学的错误是
A. ①⑤⑥ B. ②④⑦ C. ①⑥ D. ⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。

A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g)![]() H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都难溶于水,且密度比水小
B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
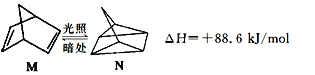
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 1/2O2(g) ═ CO2(g) + 2H2(g) △H=-a kJ·mol-1,则a 726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为 。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) △H= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
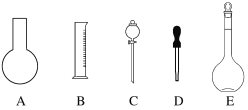
(1)①如图所示的仪器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com