
科目: 来源: 题型:
【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
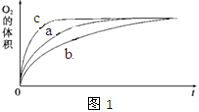
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
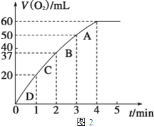
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(物质结构与性质)黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:
2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K____________(填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为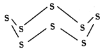 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为___________,,N2的沸点比CO的沸点__________(填“高”或“低”)。
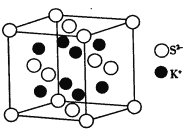
(5)K2S的晶胞结构如图所示。其中K+的配位数为_____________,S2-的配位数为__________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为__________g·cm-3(列出计算式,不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、下列转化关系中,X、Y是生活中生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:

(1)请写出反应①的化学方程式_____________________。
(2)试剂a是_________溶液(写一种即可)
(3)若试剂b是H 2 SO 4 ,工业上用E、H 2 SO 4 和NaNO 2 为原料制取高效净水剂Y(OH)SO 4 ,已知还原产物为NO,则该反应的化学方程式是________________________。
Ⅱ、(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
该反应的离子方程式是___________________。

(2)氮氧化合物是大气污染的重要盐因素,将NOx转化为无害物质是当前研究的重要课题。
①下式中X必须为无污染的物质,系数n可以为0。
NO2+G![]() N2+H2O+nX(未配平的反应式)。
N2+H2O+nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
② 若G为天然气的主要成分,则X为____________,n=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】U常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生如下分解:
[UO2(NO3)2]―→UxOy+NO2↑+O2↑(未配平)
将气体产物收集于试管中并倒扣于盛水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是( )
A.UO2 B.2UO2·UO3
C.UO3 D.UO2·2UO3
查看答案和解析>>
科目: 来源: 题型:
【题目】生物体内构成血红蛋白、叶绿素、甲状腺激素、动物骨骼的重要元素依次是
A. I、Mg、Ca、Fe B. Fe、Mg、I、Ca
C. Fe、Ca、I、Mg D. Mg、Fe、I、Ca
查看答案和解析>>
科目: 来源: 题型:
【题目】某班同学用如下实验探究过氧化氢的性质。回答下列问题:
(1)甲组同学拟配制5%的H2O2溶液,他们先从文献查得H2O2的稳定性与pH的关系如图所示。则配制H2O2溶液时应滴入几滴_____________(填“稀硫酸”或“氨水”)。
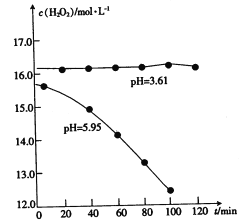
(2)乙组同学向一支试管中加入2mLFeCl2溶液,再滴入几滴甲组同学配制的H2O2溶液,最后滴人KSCN溶液,溶液变红,H2O2与Fe2+发生反应的离子方程式为_________________;另取一支试管,向其中加入SO2与BaCl2混合溶液2mL,再滴入几滴5%的H2O2溶液,现象是_____________。
(3)丙组同学取2mLKMnO4溶液于试管中,向其中滴几滴5%的H2O2溶液,发现溶液逐渐褪色,该反应中的还原剂是____________(填化学式)。
(4)丁组同学向一支试管中加入2mL5%的H2O2溶液、0.5mL乙醚、1mLlmol/LH2SO4溶液和3~4滴0.5mol/LK2Cr2O7溶液,发现上层乙醚层为蓝色(CrO5的乙醚溶液),一段时间后上层蓝色消失。
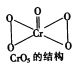
①乙醚的主要作用是____________。
②开始时,H2O2溶液与K2Cr2O7酸性溶液反应生成CrO5,该反应属于____________(填“氧化还原”或“非氧化还原”)反应。
③一段时间后,乙醚层中的CrO5与水相中的H+作用生成Cr3+并产生无色气泡,从而使蓝色逐渐消失,该反应的离子方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A. 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B. 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C. 常温常压下,22.4LH2O中含有的氢原子数为2NA
D. 标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达式均正确的是( )
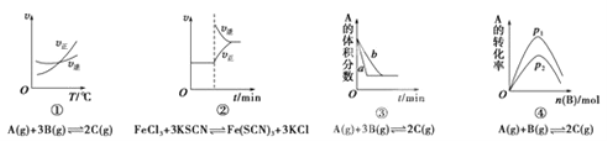
A.①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com