
科目: 来源: 题型:
【题目】下列有关实验及显色结果的叙述,错误的是
A.水浴加热条件下,麦芽糖与斐林试剂发生反应生成砖红色沉淀
B.蛋白质溶液遇双缩脲试剂变紫色
C.人的口腔上皮细胞经健那绿染色后,可以看到呈蓝绿色的线粒体
D.常温条件下,脱氧核糖核酸与吡罗红作用呈红色
查看答案和解析>>
科目: 来源: 题型:
【题目】生活处处有化学。下列说法正确的是 ( )
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是
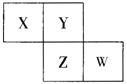
A. 氧化物对应水化物酸性W比Z强
B. Y单质与Z的氢化物水溶液反应,有沉淀生成
C. X单质氧化性强于Y单质
D. 简单离子的半径:Z<W
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案设计中,可行的是( )
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目: 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作__________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
_____Cr2O72-+_____SO32-+_____ =_____Cr3++_____SO42-+ _____H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_____________________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 _。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
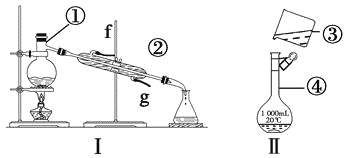
(1)写出下列仪器的名称:①____________,②____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器____________,将仪器补充完整后进行的实验操作的名称为____________;②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素:反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH)2·H2O2。过氧化尿素的部分性质如下:
CO(NH)2·H2O2。过氧化尿素的部分性质如下:
合成过氧化尿素的流程及反应装置图如下:
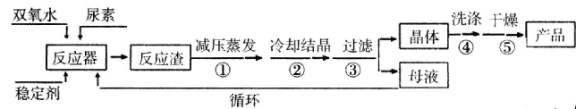
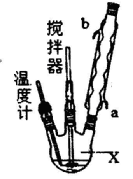
请回答下列问题:
(1)仪器X的名称是____________;冷凝管中冷却水从____________(填“a”或“b”)口进入。
(2)反应器的加热方式是_______________。
(3)搅拌器是否可用铁质材料___________(填“是”或“否”),原因是_______________。
(4)步骤① 采用减压蒸发的原因是___________。
(5)下列选项中,最适合作为步骤④ 的洗涤液是_______。
a.冰水 b.热水 c.饱和NaCl溶液 d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol/L H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应)。
① 滴定终点的现象是______________。
② 则产品中CO(NH)2·H2O2的质量分数为______________。
③ 若滴定前仰视,滴定后俯视,则测得的过氧化尿素含量_________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。下列有关叙述正确的是( )
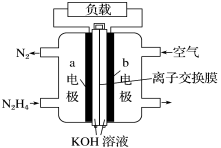
A.该燃料电池放电时,正极发生氧化反应,pH变大
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
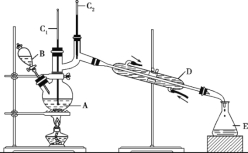
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/。c | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90 ~ 95。C,在E中收集90。C以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75 ~ 77。C馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_______________________。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________________。
(3)上述装置图中,B仪器的名称是_________________,D仪器的名称是___________________。
(4)分液漏斗使用前必须进行的操作是_____________(填正确答案标号)。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在____________层(填“上”或“下”)
(6)反应温度应保持在90~95。C,其原因是__________________________。
(7)本实验中,正丁醛的产率为___________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com