
科目: 来源: 题型:
【题目】
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有_________(填离子符号),由此可以证明该氧化还原反应为_________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________;一段时间后,溶液中有大量气泡出现,随后有红褐色沉淀生成。产生气泡的原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(双选)恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:
A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成a mol C,则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成a mol C,则下列说法中正确的是( )
A.物质A、B的转化率之比为1∶2
B.起始时刻和达平衡后容器中混合气体密度相等
C.当v正(A)=2v逆(C)时,可断定反应达到平衡状态
D.若起始时放入3 mol A和3 mol B,则达平衡时生成 3a mol C
查看答案和解析>>
科目: 来源: 题型:
【题目】1000 ml某无色待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
现进行如下实验操作(所加试剂均过量):(已知:NH4+ + OH- (浓)= NH3↑ +H2O)
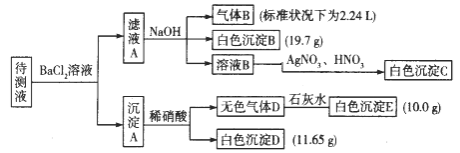
(1)原溶液中肯定存在的离子是(除Na+) ,肯定不存在的离子是 。
(2)写出生成白色沉淀B的离子方程式: 。写出沉淀A溶于稀硝酸的离子方程式:_____________________。
(3)将滤液A和沉淀A分开的操作是过滤,洗涤。洗涤的操作是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】荆门天茂实业集团为新能源领域的先行者,在中南地区拥有最大的甲醇装置并已建成年产50万吨二甲醚装置。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及如下反应。
甲醇合成反应:(i)CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.1kJmol-1
CH3OH(g)△H1=-90.1kJmol-1
二甲醚合成反应:(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.9kJmol-1
CH3OCH3(g)+H2O(g)△H2=-23.9kJmol-1
(iii)2CH3OH(g)![]() C2H4(g)+2H2O(g)△H3=-29.1kJmol-1
C2H4(g)+2H2O(g)△H3=-29.1kJmol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上以铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示) 、 、2Al(OH)3 ![]() Al2O3 +3H2O。
Al2O3 +3H2O。
(2)一定温度时,反应(i)的平衡常数数值Kp = 4.80×10-2,向容器中充入2 mol H2和1 molCO,反应(i)达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为__________(Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)二甲醚合成反应过程中两反应能量变化如图所示:
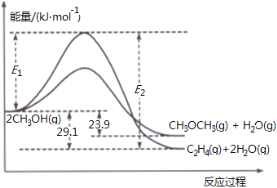
①反应速率较大的是__________(填序号 “ ii”、“ iii”),说明原因 。
②若在容器中加入催化剂,则E2 - E1将__________(填“变大”、“不变”或“变小”)。
(4)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一恒容的密闭容器中充入0.1mol·L-1CO2、0.1mol·L-1CH4,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如下图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如下图,下列有关说法不正确的是
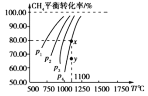
A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1100℃时该反应平衡常数为1.64(mol/L)2
D.压强为p4时,在y点:v正>v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= _____________、CO的平衡转化率= _____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A减少Fe的量 B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com