
科目: 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中, 产生H2的速率可由下图所示,影响产生氢气反应速率的因素是( )
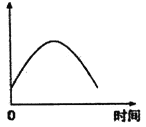
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.②③ D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子可能大量共存的是
A.常温下Kw/c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Fe2+、NO![]() 、NH
、NH![]()
B.水电离出的c(H+)=10-10mol·L—1的溶液中Na+、K+、Cl、HCO3
C.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
D.c(Fe3+)=0.1mol·L-1的溶液中:K+、Cl-、SO42-、H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列各项叙述正确的是
①常温下,0.1molCl2分别与足量NaOH溶液和水反应,转移的电子数目均为0.1NA
②1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
③标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
④1L 2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA
⑤1 L 2 mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2 NA
⑥6.0 g SiO2晶体中含有的硅氧键数目为0.4 NA
⑦1 molCH5+所含的电子数为10NA
⑧在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
⑨300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
⑩标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA
A.②③⑦⑧⑨⑩ B.①②③⑤⑧⑨ C.②⑤⑥⑦⑧ D.①②③⑦⑧⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
编组 | A | B | C | D |
强电解质 | HCl | BaSO4 | HClO | KNO3 |
弱电解质 | CaCO3 | CH3COOH | Al(OH)3 | H2CO3 |
非电解质 | Cl2 | NH3 | C2H5OH | H2O |
查看答案和解析>>
科目: 来源: 题型:
【题目】人体的肌肉细胞中含量最多的物质与过度肥胖者的脂肪细胞中含量最多的物质( )
A. 前者为蛋白质,后者为脂肪 B. 都是水
C. 都是蛋白质 D. 前者是水,后者是脂肪
查看答案和解析>>
科目: 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
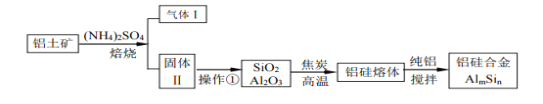
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,原因是_____________________
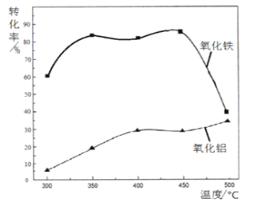
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式:_____________________。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是________________
(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:_______________________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体SiC再与Al2O3生成硅、铝单质的化学反应方程式,_________________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)==___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时 释放145 kJ的热量,写出这个反应的热化学方程式:________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检 测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
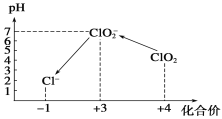
请回答:
①操作Ⅰ中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___________________。
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
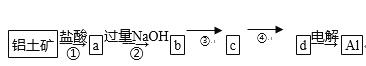
下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
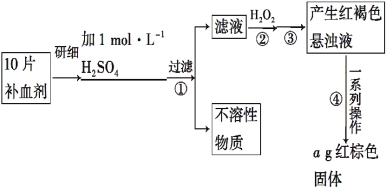
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为______________________。
(2)步骤②加入过量H2O2的目的是 _______________________。
(3)步骤④中反应的化学方程式是 _______________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、 、称量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com