
科目: 来源: 题型:
【题目】 常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到PH = 7 的溶液,混合时硫酸酸与NaOH 溶液的体积比为
A.1: 200 B.200 : 1 C.100 : 1 D.1:100
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制成240mL 0.1mol/L的稀盐酸,请回答:
(1)浓盐酸的物质的量浓度为________mol/L
(2)配制240mL 0.1mol/L的稀盐酸,应选择_________mL的容量瓶,量取浓盐酸的体积为________ml。
(3)完成本实验必需用到的仪器有:量筒、玻璃棒、烧杯、________、容量瓶等
(4)定容时,加水超过了刻度线,应怎样操作:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,下列说法正确的是
A.被氧化的元素是氯元素
B.氧化产物与还原产物的物质的量之比为l:1
C.消耗l mol还原剂,转移5 mol电子
D.净化1 L含CN-1.04 mg·L-1的废水,理论上需用2×l0-5mol C1O2
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g) == C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
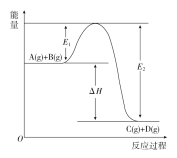
(1)该反应是__________反应(填“吸热”或“放热”)。
(2)E1表示 ,E2表示 ,ΔH=________。
(3)反应体系中加入催化剂对反应热是否有影响? (填“有影响”“无影响”),原因是 。
(4)在反应体系中加入催化剂,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
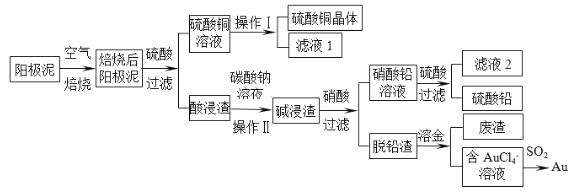
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb-2e-+SO42-=PbSO4和 。
(2)碱浸渣的主要成分是 、 。(写化学式)
(3)操作I的主要步骤为 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液2并入硝酸进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.5×10-13,Ksp(PbSO4)= 1.8×10-8,将1 mol PbSO4固体放入1L Na2CO3溶液中,充分反应后达到平衡,溶液中c(CO32-)为5mol/L,溶液体积在反应前后保持不变,则平衡后c(SO42-)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:


①温度为T1时,能作为该反应达到平衡的标志的有 ;
a.容器体积保持不变
b.容器压强保持不变
c.平衡常数K保持不变
d.气体颜色保持不变
e.v(ClNO)= v(NO)
f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=____________(注明单位)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的_________点。
查看答案和解析>>
科目: 来源: 题型:
【题目】将50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”,下同),所求中和热 ,简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1醋酸代替盐酸进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
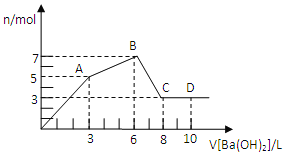
A.图中C点铝元素存在形式是AlO2—
B.向D点溶液中通人C02气体,立即产生白色沉淀
C.原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D.OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
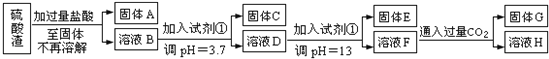
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
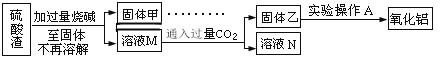
(5)此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2molL-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯元素的单质及其化合物在生产生活中应用极其广泛。请完成下列填空:
Ⅰ:氯气性质探究
设计下图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。

(1)A中放置固体二氧化锰的装置名称是___________________。
(2)装置B的作用是___________________。
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 。
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 。
Ⅱ:制备HClO
(5)设计装置E代替上图的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。
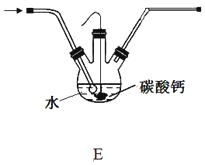
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) 。
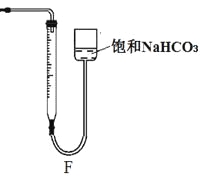
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有 、 (写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为 mol·L-1(用含M、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com