
科目: 来源: 题型:
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的Fe2+、Cu2+、SO42-和Na+,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁及金属铜,请根据下列流程在标有①﹣⑤的方框和括号内填写物质名称或操作方法,完成回收硫酸亚铁及金属铜的简单实验方案。
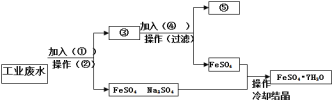
请完成流程图空白:
① 。② 。
③ 和 。④ 。
⑤ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g) +4H2O(g) ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ/mol
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ/mol
C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol
(1)氢气的燃烧热是__________________。
(2)已知:H2O(l)=H2O(g ) △H=+44.0 kJ/mol写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:_____________________。
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6 kJ,计算混合气体中H2和C3H8的体积比是________________。
(4)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol当反应中转移10mol电子时,燃烧的丙烷(C3H8)的质量是________ g,生成的CO2在标准状况下的体积是_________ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别
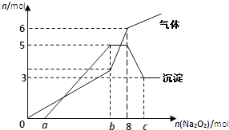
A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118,中子数为175的超重元素,该元素原子核的中子数与核外电子数之差为( )
A. 57 B. 47 C. 61 D. 293
查看答案和解析>>
科目: 来源: 题型:
【题目】
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体;
d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是 (填序号)
(3)已知:I2+2S2O32﹣═2I﹣+S4O62﹣.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol· L﹣1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
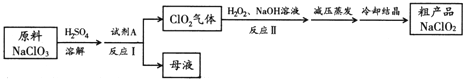
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(3) 反应Ⅱ的离子方程式为 。
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是_________________。
(5) NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(6) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2。若处理含NaCN 4×10-5mol ·L-1的废水 1000L,至少需要ClO2 的质量为___________g。
(7) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com