
科目: 来源: 题型:
【题目】已知:C(s,金刚石)=C(s,石墨) △H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A. △H1=△H2 B. △H1>△H2
C. △H1<△H2 D. 金刚石比石墨稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】“组成不同生物的元素含量有不同”。对此现象的合理解释是( )
A. 组成细胞的化学元素在含量上具有差异性
B. 生物界与非生物界在元素含量上具有差异性
C. 生物根据自身生命活动的需要,有选择地从环境中吸收的元素
D. 生物体内元素的存在形式各不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=____________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是_______。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH向电极____移动(填a或b),负极的电极反应式为________________。
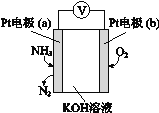
查看答案和解析>>
科目: 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g)![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
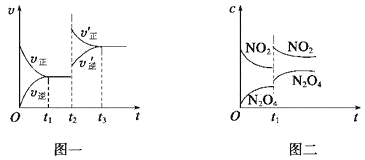
A. 图一t2时改变的条件可能是升高了温度或增大了压强
B. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法正确的是( )
A.该合金中铁的质量为5.4 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
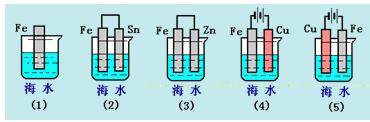
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,将3molA和lmolB气体通入体积为2L的密闭容器中(保持容积不变),发生如下反应:3 A(g)+B(g) ![]() xC(g) △H<0;在2min时达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写列空白:
xC(g) △H<0;在2min时达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为__________。
(2)x=___________,平街常数K=___________。
(3)若继续向原平衡混合物的容器中通入少量氯气 (假设氮气和A、B、C都不反应)后,化学平衡(填字母)____ ________。若通入气体A后,化学平衡将___________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的作器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)=__________mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的下种物质的物质的分n (A)、n(B)、n(C)之间应该满足的关系式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于组成细胞的化学元素和化合物的说法中,错误的是
A. 胰岛素和性激素的化学本质分别是蛋白质和固醇
B. 休眠种子细胞中自由水与结合水比值上升,有利于种子的储藏
C. 蛋白质的基本组成单位是氨基酸,组成蛋白质的氨基酸种类约有20种
D. 动物与植物细胞所含的化学元素的种类大体相同,但含量有差异
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com