
科目: 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A.SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B.SO2为0.25 mol ·L-1
C.SO2、SO3均为0.15 mol ·L-1 D.SO3为0.4 mol ·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2CO3水解:CO![]() +H2O == H2CO3+2OH-
+H2O == H2CO3+2OH-
B.NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.Cu与稀HNO3反应:Cu+4H++2NO![]() =Cu2++2NO↑+2H2O
=Cu2++2NO↑+2H2O
D.醋酸除水垢:CO![]() +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
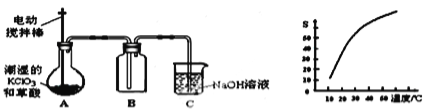
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO23H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
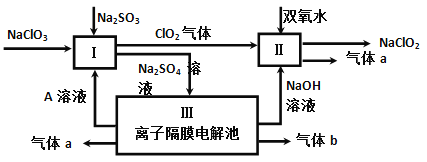
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明缺硒可导致克山病。克山病是一种地方性心肌病,急重症病人可发生猝死。营养学和流行病学界专家认为,成人每天硒的摄取量约在40μg~100μg就可满足人体需要。根据资料,下列解释不正确的是()
A. 硒是人体必需的化学元素
B. 硒在人体生长发育过程中的作用不可替代
C. 硒的作用重大,只要有了硒,人体就能正常生长发育
D. 硒是人体必需的微量元素
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下,5.6LCH4的质量为 克,共含有 个原子。
(2)质量相同的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 (填分子式,下同),在相同温度和相同压强条件下,体积最大的是 。
(3)常温下,27.9g水中溶解12.1g Cu(NO3)2·3H2O恰好达到饱和,所得溶液密度为1.20g /cm3,求该溶液中NO3-的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)
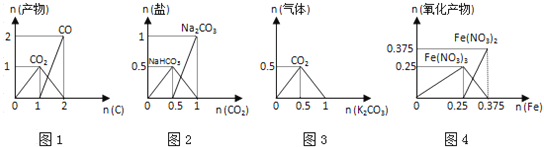
A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
C.图3:n(HCl)=1mol时,K2CO3逐步加入到HCl溶液中在敞口容器反应生成的气体
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式为 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com