
科目: 来源: 题型:
【题目】某高校老师要求学生配制0.1 mol/L的KMnO4溶液100mL。完成下列实验。
【实验一】研究温度对反应速率的影响,学生取两只试管,均加入4mL 0.1 mol/L的KMnO4酸性溶液和10mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。写出此反应的离子方程式: 。
【实验二】测定某乙二酸溶液的浓度,具体操作为:
(1)滴定:准确量取25.00 mL乙二酸溶液于锥形瓶中,加少量酸酸化,将KMnO4溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。
请解释原因: 。待到 ,证明达到滴定终点。
(2)计算:再重复上述操作2次,记录实验数据如下。
序号 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 22.10 |
则此乙二酸溶液的浓度为 。
(3) 误差分析:下列操作会导致乙二酸溶液浓度偏高的是 。
A. 配制KMnO4溶液定容时,仰视观察刻度线
B.未用待测液乙二酸润洗滴定管
C.滴定前锥形瓶有少量水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目: 来源: 题型:
【题目】[物质结构与性质]
将汽车尾气中含有的CO利用不仅能有效利用资源,还能防治空气污染。工业上常用CO与H2在由Al、Zn、Cu等元素形成的催化剂作用下合成甲醇。
(1)如图是某同学画出CO分子中氧原子的核外电子排布图:![]() ,请判断该排布图 (填“正确”或“错误”),理由是 (若判断正确,该空不用回答)。
,请判断该排布图 (填“正确”或“错误”),理由是 (若判断正确,该空不用回答)。
(2)写出与CO互为等电子体(电子总数相等)的一种分子和一种离子的化学式 。
(3)向CuSO4溶液中加入足量氨水可得到深蓝色[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中 所含配位键是通过配体分子的 给出孤电子对, 接受电子对形成,SO42-的空间构型是 ,该物质中N、O、S三种元素的第一电离能大小顺序为 > > (填元素符号)。
(4)甲醇与乙烷的相对分子质量相近,故二者分子间的作用力(范德华力)相近,但是二者沸点的差距却很大,造成该差异的原因是 ;在甲醇分子中碳原子轨道的杂化类型为 。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
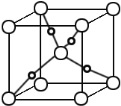
① 在该晶胞中,Cu+ 的配位数是 ,
② 若该晶胞的边长为a pm,则Cu2O的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是( )
A.Cl2+H2O![]() HCl+HClO
HCl+HClO
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等;
②单位时间内amol A生成的同时生成3amol B;
③A、B、C的浓度不再变化;
④容积不变的密闭容器中混合气体的总压强不再变化;
⑤混合气体的物质的量不再变化;
⑥单位时间消耗amol A,同时生成3amol B;
⑦A、B、C的分子数目比为1:3:2。
A.②⑤ B.②⑦ C.①③ D.⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯醛(结构简式为CH2=CH-CHO)能发生的化学反应有
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚
A. ①③⑤⑦ B. ②④⑥ C. ①④⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A. 均采用水浴加热 B. 制备乙酸丁酯时正丁醇过量
C. 均采用边反应边蒸馏的方法 D. 制备乙酸乙酯时乙醇过量
查看答案和解析>>
科目: 来源: 题型:
【题目】元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期主族元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:

已知:①Cu2O+2H+=Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
沉淀物 |
|
|
|
|
开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)反应I中,与铁元素有关反应的离子方程式为 、 。
(2)y的数值范围是 。
(3)以上步骤中的NaOH可以用__________代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为_____________________。
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com