
科目: 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图所示。下列说法中不正确的是

A.生成Al(OH)3沉淀的最大质量为0.78g
B.加入70ml NaOH 时溶液呈碱性
C.![]() 的最大值为1.5
的最大值为1.5
D.![]() 的取值范围为0≤ a<45mL
的取值范围为0≤ a<45mL
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修物质结构与性质】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于 区,单质X的晶体类型为 ,其中X原子的配位数为 。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为 ,其同周期元素中,第一电离能最大的是________________(写元素符号)。元素Y的含氧酸中,酸性最强的是_____________(写化学式),该酸根离子的立体构型为_____________。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(5)X与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为_______________,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是 cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液的酸碱性可用酸度(AG)表示,已知AG =lg![]() ,室温下将0.01molL﹣l盐酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG变化如图所示,下列说法正确的是
,室温下将0.01molL﹣l盐酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG变化如图所示,下列说法正确的是
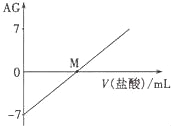
A.室温下,0.01 molL﹣l盐酸的AG=12
B.M点时溶液中:c(NH4+)=c(Cl﹣)
C.M点加入盐酸的体积大于20.00 mL
D.M点以后NH4+的水解程度逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。下列说法不正确的是

A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C.在一定条件下,色氨酸可发生缩聚反应
D.褪黑素与色氨酸结构相似,也具有两性化合物的特性
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置检验乙烯时不需要除杂的是( )
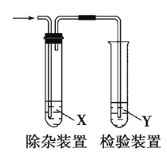
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目: 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 在晶体中只要有阴离子就一定有阳离子
B. 在晶体中只要有阳离子就一定有阴离子
C. 金属能导电是因为金属晶体中的自由电子在外加电场作用下可发生定向移动
D. 分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热为△H=-241.8kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出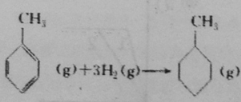 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
⑥25℃,101kPa,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
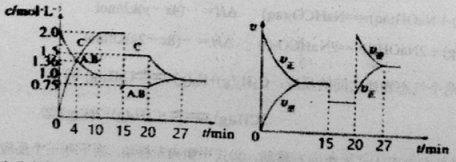
A.4min时反应第一次达到平衡
B.15min时降低压强,20min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.15~20min该反应使用了催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】I.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) △H=+44.0kJ·mol-1
写出表示甲醇燃烧热的热化学方程式 。
II.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H>0
CO2(g)+3H2(g) △H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反映前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
① v正(CH3OH)=3v逆(H2)
混合气体的密度不变
混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
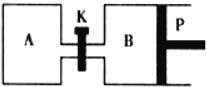
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com