
科目: 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
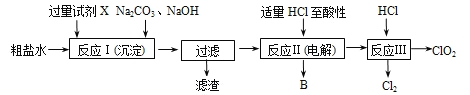
(1)粗食盐水中含有Ca2+、Mg2+、SO![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO![]() ,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有____________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
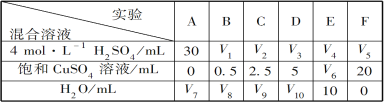
请完成此实验设计,其中:V1=___________,V6=___________,V9=___________;
反应一段时间后,实验A中的金属呈___________色,实验E中的金属呈___________色;
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:CO(g)+ H2O(g)![]() CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2 molL-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2 molL-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)当CO的起始浓度仍为2 molL﹣1,H2O(g)的起始浓度为6 molL﹣1,求平衡时CO的转化率?
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
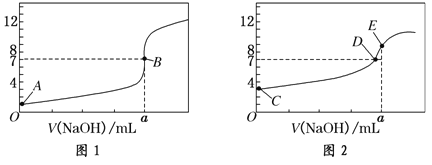
以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:
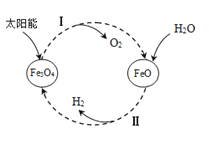
(1)过程Ⅰ:2Fe3O4(s)![]() 6FeO(s)+O2(g) ΔH=+313.18 kJ/mol
6FeO(s)+O2(g) ΔH=+313.18 kJ/mol
① 将O2分离出去,目的是提高Fe3O4的__________________。
② 平衡常数K随温度变化的关系是 。
③ 在压强p1下,Fe3O4的平衡转化率随温度变化的α(Fe3O4)~T曲线如图1所示。若将压强由p1增大到p2,在图1中画出p2的α(Fe3O4)~T曲线示意图。
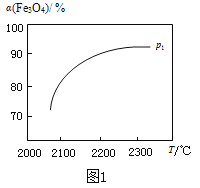
(2)过程Ⅱ的化学方程式是 。
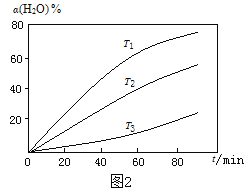
(3)过程Ⅱ,其他条件不变时,在不同温度下,H2O的转化率随时间的变化α(H2O)~t 曲线如图2所示。比较温度T1、T2、T3的大小关系是 ,判断依据是 。
(4)科研人员研制出透氧膜(OTM),它允许电子、O2-同时透过,可实现水连续分解制H2。工作时,CO、H2O分别在透氧膜的两侧反应。工作原理示意图如下:
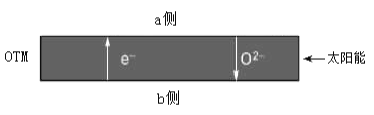
H2O在___________侧反应(填“a”或“b”),在该侧H2O释放出H2的反应式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
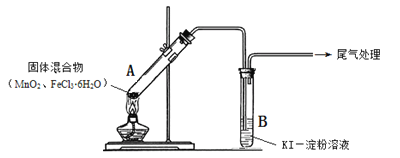
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是
A. 正极为Cu,负极为Fe,电解质溶液为FeCl3
B. 正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C. 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D. 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com