
科目: 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素名称为 ,生成1mol O2时转移电子的数目是 。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称: 。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为 。
MnCl2+Cl2↑+2H2O,其离子方程式为 。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为 .
(5)以上两个反应都用到MnO2,其作用分别是 、 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 增大压强会加快化学反应速率,其原因是增加了活化分子的百分率
D. 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是
A. SO2具有氧化性,可用于漂白纸浆
B. 炭具有还原性,一定条件下能将二氧化硅还原为硅
C. BaCO3、BaSO4都难溶于水,均可用做钡餐
D. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
查看答案和解析>>
科目: 来源: 题型:
【题目】用含有32P的磷酸盐培养液培养洋葱根尖细胞(含P的物质或结构均可被32P标记),一段时间后,细胞中具有32P的结构及化合物是( )
①脱氧核糖 ②细胞膜 ③核糖体 ④脂肪 ⑤线粒体 ⑥中心体
A. ①②③⑤⑥ B. ②③⑥ C. ②③⑤⑥ D. ②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】现有四组混合物:①汽油与氯化钠溶液混合②酒精与水混合③食盐水与碘水④硝酸钠溶液中少量氯化钾混合,分离以上各混合物的正确方法依次是( )
A. 分液、萃取、蒸馏、过滤 B. 萃取、蒸馏、分液、过滤
C. 分液、蒸馏、萃取、结晶 D. 蒸馏、萃取、分液、结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】某两种气态烃的1L混合气体,完全燃烧生成1.4LCO2(g)和2LH2O(g),体积均在相同的情况下测得,该混合物可能是( )
A. C2H6 C2H4 B. CH4 C2H4 C. CH4 C3H6 D. C2H6 C3H6
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,容易分解,工业上制备高铁酸钾的基本流程如下图所示:
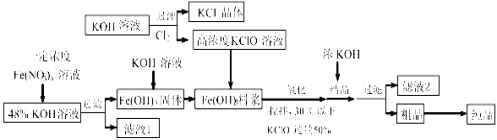
(1)K2FeO4中铁化合价为 在农业生产中,滤液1可用作。
(2)氧化过程中搅拌目的是 由粗品到纯品的实验方法是
(3)上述Fe(OH)3浆料中加入KClO溶液进行氧化过程中,发生反应的离子方程式是:,控制反应温度30℃ 以下的原因是: 。
(4)结晶过程中加入浓KOH溶液的作用是: 。
(5)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应 2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为

(4)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
写出电解饱和食盐水的离子方程式 。
离子交换膜的作用为: 、 。
精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2: ;
②NaHSO4: ;
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________________
(2)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O,①反应中还原剂是 ,被还原的元素是 ,(用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为_________L,
②用双线桥法标出上述反应中电子转移的方向和数目。
(3)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl.某学生设计了如图所示方案提取纯净的NaCl溶液.(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
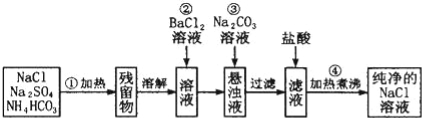
①150℃时,一定量的NH4HCO3完全分解后所得气体的平均相对分子质量为 (保留至小数点后一位).
②操作③所得到的悬浊液与胶体的本质区别是 .
③进行操作②后,判断SO42﹣是否已除尽方法是 .
④操作②加BaCl2溶液后生成沉淀,不必进行过滤就可进行操作③加碳酸钠溶液,其理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com