
科目: 来源: 题型:
【题目】某有机物A的分子式为C4HxCly,其中x+y=10,已知该有机物有9种同分异构体(不考虑立体异构),则X可能为:①2,②3,③8,④10。下列组合正确的是( )
A.①③ B.①② C.②③ D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,甲、乙两烧杯均盛有5mLpH=11的某一元碱溶液,向乙烧杯中加水稀释至pH=10。关于甲、乙两烧杯中溶液的描述不正确的是( )
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(H+)甲=c(H+)乙
C.若分别用等浓度的HCl溶液完全中和,所得溶液的PH:甲≤乙
D.若分别与5mLpH=3的HCl溶液反应,所得溶液的pH:甲≤乙
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
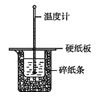
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)试分析下列各种情况下微粒间作用力的变化情况,用“离子键”“极性键”或“非极性键”填空:
①NaCl溶于水时被破坏的是 。
②HCl溶于水时被破坏的是 。
③Na2O熔化时被破坏的是 。
④NaOH和HCl反应时形成 和 。
⑤反应2H2+O2![]() 2H2O中,被破坏的是 ,形成的是 。
2H2O中,被破坏的是 ,形成的是 。
⑥Ca(OH)2和NH4Cl反应时,被破坏的化学键有 ,形成的化学键有 。
(2)下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的反应是 (填字母)。
A.NH4Cl=NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是________;不存在化学键的是________。
(2)属于共价化合物的是________;属于离子化合物的是________。
(3)将NaHSO4溶于水,破坏了NaHSO4中的________,写出其电离方程式__________________;
NaHSO4在熔融状态下电离,破坏了________,写出其电离方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(能力挑战题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的名称。
A ,B ,C ,D ,E 。
(2)用电子式表示离子化合物A2B的形成过程:_________ ____________。
(3)写出D元素形成的单质的结构式: ____________________。
(4)写出下列物质的电子式:
E与B形成的化合物: ;A、B、E形成的化合物: ;D、E形成的化合物: ___________。
(5)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”)化合物,存在的化学键是 ,写出A2B2与水反应的化学方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:(均用NA表示阿伏伽德罗常数的值)
(1)0.1molAl2(SO4)3中含有离子总数为 个,Al3+的质量是 ,SO42-的物质的量是 ;
(2)若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是 g;
(3)将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是 ;
(4)现有14.4g CO和CO2的混合气体,在标准状况下其体积为8.96L;
①该混合气体的平均摩尔质量为 ;
②混合气体中碳原子的个数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是 ,氧化产物是 ,用双线桥法表示上述反应电子转移方向和数目;
(2)计算当有73.0克HCl被氧化时,消耗MnO2的物质的量为 ;
(3)在反应MnO2+4HCI![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com