
科目: 来源: 题型:
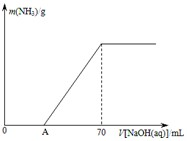 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
查看答案和解析>>
科目: 来源: 题型:
一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g);△H>0,达到平衡状态,现进行如下操作:
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
查看答案和解析>>
科目: 来源: 题型:
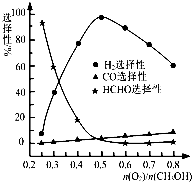 (2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.| 1 |
| 2 |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:
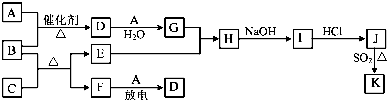
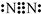
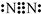
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

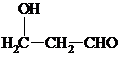
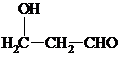
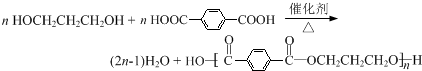

 (须注明反应条件).
(须注明反应条件).查看答案和解析>>
科目: 来源: 题型:
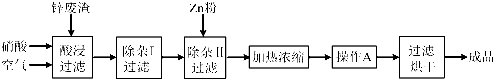
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:
 (2012?通州区一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
(2012?通州区一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
根据下列操作与产生的现象,所得结论正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com