
科目: 来源: 题型:
【题目】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
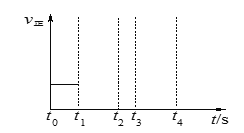
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
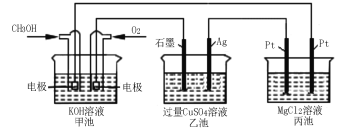
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)又名大苏打、海波,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室常以硫化钠(Na2S)为原料制取Na2S2O3。
实验项目I:工业级硫化钠的纯化。
本实验对Na2S的纯度要求较高,利用图1所示的装置将工业级的Na2S提纯。


图1 图2
已知:Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图1所示连接仪器,水浴加热;
冷凝管的作用是 。
向冷凝管中通入冷却水的方向是从 口进水(填“a”或“b”)。
③ 待烧瓶中固体不再减少时,停止加热,将烧瓶取下,趁热过滤,除去不溶物;
④ 将滤液转移至烧杯中,冷却结晶,过滤;
⑤ 将所得固体用少量 (填试剂名称)洗涤,干燥后得到Na2S·9H2O晶体。
实验项目II:硫代硫酸钠的制备。
制备步骤依次为:
① 称取一定质量的硫化钠晶体和碳酸钠固体,溶于水,转移至三颈瓶中;
② 按图2所示连接仪器,并在各仪器中加入相应的试剂,打开分液漏斗的活塞,使反应生成的气体较均匀地通入三颈瓶中,并用电磁搅拌器不断搅拌;
仪器A的名称为 。
写出三颈瓶中发生的反应的化学方程式: 。
③ 随着气体的通入,逐渐有浅黄色的硫析出,继续通入气体至溶液pH接近7,停止通入气体,取下三颈烧瓶,过滤;
实验过程中若未及时停止通入气体可能产生的后果为 。
④ 将滤液置于蒸发皿中加热,待 时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2![]() Li2O2下列有关说法正确的是( )
Li2O2下列有关说法正确的是( )
A.充电时,多孔金制成的电极外接电源负极
B.放电时,Li+从负极向正极移动
C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
D.该电池可使用含Li+的水溶液作电解质溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2NO(g) +O2(g)![]() 2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
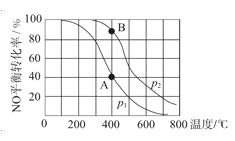
A.p1<p2
B.该反应的△H<0
C.A、B两点的平衡常数:K(A)<K(B)
D.A、B两点的化学反应速率:v(A)<v(B)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁、是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是

A.在丁中滴加甲开始反应的离子方程式:HCO3—+ Ba2++OH—= BaCO3↓+ H2O。
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为AlCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
A.物质的量之比为16∶11 B.密度之比为11∶16
C.摩尔质量之比为11∶16 D.体积之比为11∶16
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12。下列说法中正确的是( )
A.由于Ksp(AgCl)>Ksp(AgI),所以AgI可以转化为AgCl
B.向Ag2CrO4溶液中加入固体K2CrO4,溶解平衡逆向移动,所以Ag2CrO4的Ksp减小
C.由于Ksp(Ag2CrO4)<Ksp(AgCl),所以沉淀AgCl容易转化为沉淀Ag2CrO4
D.常温下,AgCl饱和溶液中加入NaI,若要使溶液中开始转化为AgI,则NaI的浓度必不低于0.75×10-11 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com