
科目: 来源: 题型:
【题目】下列关于氯气及含氯化合物的说法中,正确的是( )
A.液氯是氯气的水溶液,它能使干燥的有色布条褪色
B.氯气和NaOH溶液反应可制备消毒液
C.氯气可用于自来水的杀菌消毒,是因为氯气的毒性
D.新制饱和氯水在光照下有气泡产生,其主要成分是氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )
①钠比水轻②钠的熔点较低③钠与水反应时要放出热量④钠与水反应后溶液呈碱性
A.①④ B.①②④ C.①③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于锥形瓶在中和滴定中的作用和使用方法错误的是( )
A. 一般用于盛装被滴定的溶液
B. 使用前用蒸馏水洗后还须用待测液润洗
C. 若瓶中装入被滴定溶液量太少,可向瓶中加入一定量蒸馏水稀释
D. 滴定时应用右手顺时针方向旋摇锥形瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】已知乙烯能被酸性高锰酸钾溶液氧化成 CO2。既可以用来鉴别乙烷和乙烯,又 可以用来除去乙烷中混有的乙烯的方法是
A.在空气中燃烧 B.通入足量溴水中
C.通入酸性高锰酸钾溶液中 D.通入水中
查看答案和解析>>
科目: 来源: 题型:
【题目】DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
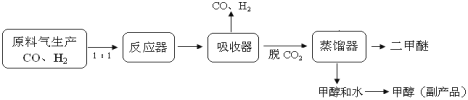
在一定的温度(230-2800C)、压强(2-10MPa)和催化剂作用下,反应器中进行下列一些反应:
CO(g)+2H2(g)![]() CH3OH(g)△H=—90.7kJ·mol—1
CH3OH(g)△H=—90.7kJ·mol—1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=—41.2kJ·mol—1
CO2(g)+H2(g)△H=—41.2kJ·mol—1
反应器中总反应式可表示为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),则该反应的△H = 。
CH3OCH3(g)+CO2(g),则该反应的△H = 。
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变 B.容器内压强保持不变
C.v(CO2)︰v(H2)=1︰3 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(3)二甲醚也可以通过CH3OH分子间脱水制得2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
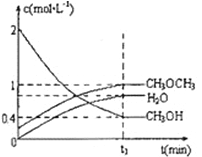
T1℃时,若改变起始浓度,某时刻各组分浓度依次为:C(CH3OH)=0.4mol/L 、C(H2O)=0.6 mol/L、C(CH3OCH3)=
1.2 mol/L,此时正、逆反应速率的大小:V正_______V逆(填“>”、“<”、或“=”)。
(4)如图为二甲醚燃料电池的工作原理示意图。请回答下列问题:
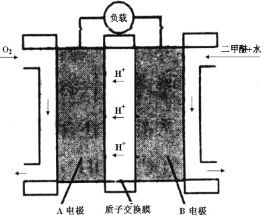
①A电极是 极。
②B电极上发生的电极反应式是 。
③若燃料电池中通入二甲醚(沸点为-24.9 ℃)的速率为1.12L/min(标准状况),以该燃料电池作为电源电解2 mol·L—1CuSO4溶液500mL,则通电30秒钟后理论上在阴极可析出金属铜 g(假设整个过程中,能量利用率为75%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 + ![]() Fe2+ +
Fe2+ +![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 (用含x、y表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
A. 碘和氯化钾 B. 金刚石和重晶石
C. 二氧化硅和干冰 D. 二氧化碳和甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com