
科目: 来源: 题型:
【题目】高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:


(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_______________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 _____________________。
(4)已知:2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是__________________(填化学式)
②A、B、C中盛放的药品依次可以是__________(选填:“I”“II”“III”)。
I.abd II.cbe III.bcf
(5)过滤用到的主要玻璃仪器是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g)![]() B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A. 若a=b+c时,B的物质的量分数变大 B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂质的方法错误的是( )
物质(括号内为杂质) | 除杂方法 | |
A | CO2(O2) | 灼热的铜网 |
B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
C | CaCl2溶液(盐酸) | 加入过量CaCO3 , 过滤 |
D | CO2(CO) | 通入O2 点燃 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2L NH3所含的原子数为2NA
B. 常温常压下,80g SO3含有的氧原子数为3NA
C. 标准状况下,22.4L H2中所含原子数为NA
D. 一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A. 是否是具有规则几何外形的固体
B. 物理性质是否有各向异性
C. 是否是具有美观对称的外形
D. 内部构成微粒是否在空间呈有规则的重复排列
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A.用蒸馏的方法制取蒸馏水
B.用过滤的方法除去NaCl溶液中含有的少量KNO3
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热的反应一定是吸热反应
B.所有的化学反应都有能量变化
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源
查看答案和解析>>
科目: 来源: 题型:
【题目】分现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)元素A在周期表中的位置是________;D、E、F形成的简单离子中半径最大的是_______(填离子符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为________。
(3) E与F的最简单气态氢化物中稳定性较强的是________(填化学式)。
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反应A中, 4mol HCl被氧化,放出115.6kJ的热量。
Ⅱ、![]()
①反应A的热化学方程式是________________________。
②断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—0 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究重点。 已知利用FeO与Fe3O4循环制氢的相关反应如下:
反应I. H2O(g)+3FeO(s) ![]() Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
反应II 2 Fe3O4(s) ![]() FeO (s) + O2(g) △H=b kJ mo1-1。
FeO (s) + O2(g) △H=b kJ mo1-1。
(1) 反应:2H2O(g)=2H2(g)+O2(g) △H =________(用含 a、b的代数式表示)kJ mo1-1。
(2)上述反应中a<0、b>0,从能源利用及成本的角度考虑,实现反应II可采用的方案是________。
(3)900℃时,在甲、乙两个体积均为2.0 L的密闭容器中分别投入0.60 mol FeO(s)并通入0.20 mol H2O(g),甲容器用 FeO细颗粒,乙容器用FeO粗颗粒。反应过程中H2的生成速率的变化如图1所示。
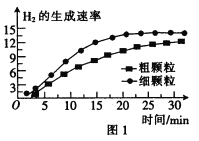
①用FeO细颗粒和FeO粗颗粒时,H2的生成速率不同的原因是__________。.
②用FeO细颗粒时H2O(g)的平衡转化率与用FeO粗颗粒时H2O(g)的平衡转化率的关系是___________(填“前者大”“前者小”或“相等”)。
(4)FeO的平衡转化率与温度的关系如图2所示。请在图3中画出1000℃、用FeO细颗粒时,H2O(g)转化率随时间的变化曲线(进行相应的标注)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com