
科目: 来源: 题型:
【题目】热化学方程式中化学式的右边要注明物质状态,主要因为( )
A. 反应热与物质呈现的状态有关
B. 可以具体说明反应进行的情况
C. 物质呈现的状态与生成什么物质有关
D. 说明反应条件
查看答案和解析>>
科目: 来源: 题型:
【题目】现有BaCl2和NaCl的混合溶液V L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+) 为
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)将2.3 g 金属钠投入到2.0 mol/L 100 mL的MgCl2溶液中,完全反应后,所得溶液中Mg2+的物质的量浓度为__________(假定反应后溶液体积不变);如果将钠、镁、铝均为0.3 mol分别与100 mL浓度为1 mol/L的HCl溶液反应,产生氢气的体积比为____________。
(3)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为__________。
(4)青铜是人类历史上的一项伟大发明。工业冶炼铜的原理主要是:
(Ⅰ)2Cu2S(硫化亚铜)+3O2![]() 2Cu2O+2SO2↑
2Cu2O+2SO2↑
(Ⅱ)2Cu2O(氧化亚铜)+Cu2S![]() 6Cu+SO2↑
6Cu+SO2↑
①用“单线桥法”表示出上述反应(Ⅰ)中电子转移的方向和数目。
2Cu2S(硫化亚铜)+3O2![]() 2Cu2O+2SO2↑
2Cu2O+2SO2↑
②该反应(Ⅰ)中的还原产物是____________;反应(Ⅱ)中被氧化的物质是____________。
③若反应(Ⅰ)和反应(Ⅱ)均转移的电子数为1.806×1024,则在标准状况下产生的二氧化硫的体积为_____________ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是

A.H2A的电离方程式为:H2A![]() H++HA- ,HA-
H++HA- ,HA-![]() H++A2-
H++A2-
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D.pH=4.0时,图中n(HA-)约为0.0091mol
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
A.v(O2)=0.01 mol·L-1·s-1 B.v(NO)=0.08 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1 D.v(NH3)=0.001 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 生铁、不锈钢和黄铜都属于合金
B. 淀粉、油脂和蛋白质都属于天然高分子化合物
C. 水泥、玻璃和陶瓷都属于无机非金属材料
D. 天然气、液化石油气和汽油的主要成分都属于烃类
查看答案和解析>>
科目: 来源: 题型:
【题目】元素性质呈现周期性变化的根本原因是( )
A.元素的相对原子质量递增,量变引起质变
B.元素原子的核外电子排布呈周期性变化
C.元素的原子半径呈周期性变化
D.元素的化合价呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水厂的水源水(原水)通常含有各种杂质,必须经过去除固体杂质和悬浮物、消毒、去除异味等一系列净化工序(即净化过程),才能达到使用标准.原水净化有下列措施:①过泣,②添加混视凝剂,③加入活性炭,④加入消毒剂。你认为正确的顺序是( )
A.①②③④ B.②①③④ C.②③①④ D.④①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】 市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐、硒营养盐、低钠营养盐、加碘食盐等十多种营养、保健盐。下列说法正确的是
A. 加碘食盐是在食盐中加入了碘单质
B. 钙营养盐是在食盐中加入了氧化钙或碳酸钙等含钙的化合物
C. 低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质
D. 各类营养食盐的主要成分都是氯化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
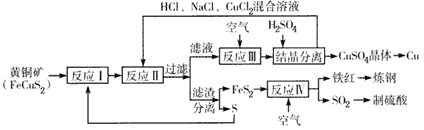
注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com