
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3-
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )

A. 腐蚀过程中,负极是c
B. 正极反应是 O2+ 4e-+2H2O = 4OH-
C. 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况)
D. 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)x值等于________________;
(2)A的转化率为 ;
(3)如果增大反应体系的压强,则平衡体系中C的质量分数 (增大、减小、不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高乙醇的产率
B.充入大量CO2气体可提高H2的转化率
C.加压可以增大正、逆反应速率,使平衡向正反应方向移动
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是( )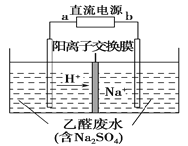
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+
D.电解过程中,阴、阳极还分别产生少量的O2和H2
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
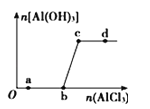
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
D.d点对应的溶液中:K+、NH4+、I﹣、HCO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质溶液的燃料电池中发电,电池负极反应式为( )
A. H2-2e-=2H+ B. H2+2OH--2e-=2H2O
C. O2+4H++4e- =2H2O D. O2+2H2O+4e-=4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3→K2O+Na2O+X↑(未配平),已知X为单质,在反应中NaN3失去电子.则该反应的氧化剂为______,X的化学式为______.
(2)工业上制取高纯度MnO2的某一步骤如图所示:
![]()
请写出该反应的离子方程式__ ___.
(3)草酸钙晶体(CaC2O4H2O)可用作分离稀有金属的载体.
①在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=__________molL﹣1min﹣1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号).
A.平衡不移动,CaO的质量不变
B.平衡发生移动,且CaC2O4的分解率增大
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
②某温度下,向0.3mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32﹣(aq)+CaC2O4(s)CaCO3(s)+C2O42﹣(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42﹣)= molL﹣1.已知:该温度下,KSP(CaC2O4)=5.0×10﹣9;KSP(CaCO3)=2.5×10﹣9.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com