
科目: 来源: 题型:
【题目】维生素是参与生物生长发育和新陈代谢所必须的物质,中学生每天需要补充一定量的维生素C。下列食品中维生素C含量最丰富的是
A.植物油 B.馒头 C.牛肉 D.橙子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )。
A. CO32—、Cl— B. NO3—、Cl—
C. NO3—、SO42— D. OH—、NO3—
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于加成反应的是
A. 乙烯使溴水褪色
B. 甲烷与氯气在光照条件下的反应
C. 苯和液溴在铁作催化剂的条件下反应
D. 乙醇与氧气在铜作催化剂及加热条件下的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】 有关溴乙烷的下列叙述中,正确的是
A. 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成
B. 溴乙烷不溶于水,能溶于大多数有机溶剂
C. 溴乙烷与NaOH的醇溶液反应,可生成乙醇
D. 溴乙烷通常用溴与乙烷直接反应来制取
查看答案和解析>>
科目: 来源: 题型:
【题目】利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图所示,a、b为惰性电极。利用该装置可将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的。下列说法不正确的是( )
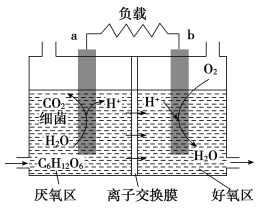
A.a为负极,电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.反应过程中产生的质子透过离子交换膜扩散到好氧区
C.装置中的离子交换膜是阳离子交换膜
D.该装置可把电能转化为生物质能
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择____________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:_________________________。
(2)图2中,钢闸门C做____________极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为____________,检测该电极反应产物的方法是___________________。
(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁﹣次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的__________极(填“正”或“负”)。F电极上的电极反应式为________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______________________。
(4)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____________________________。
②若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为____________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
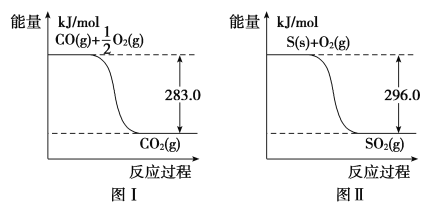
则:(1)① 不用通入O2氧化的方法除去CO的原因是____________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
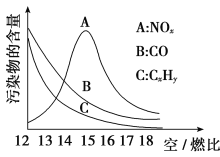
①随空/燃比增大,CO和CxHy的含量减少的原因是_______________________。
②当空/燃比达到15后,NOx减少的原因可能是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.改变条件,反应物的转化率增大,平衡常数也一定增大
B.反应2NO2(g)===N2O4(g) ΔH<0,升高温度该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.平衡常数为K=![]() 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2![]() CO+H2O
CO+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com