
科目: 来源: 题型:
【题目】Ⅰ.机动车废气排放已成为城市大气污染的重要来源。
(1)气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
(2)汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
Ⅱ.在体积恒定的密闭容器中投入物质A和物质B在适宜的条件下发生反应:
A(s)+2B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
(1)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图所示。
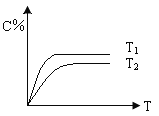
则T1 T2(填“>”、“<”或“=”),该反应的正反应的△H 0(填“>”、“<”或“=”)。
(2)若该反应的逆反应速率与时间的关系如下图所示:

①由图可见,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,则t8时改变的条件是 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g);△H﹤0,当反应达到平衡状态,测得混合气体总物质的量为2.1 mol。则平衡时SO2的体积分数为 ;
2SO3(g);△H﹤0,当反应达到平衡状态,测得混合气体总物质的量为2.1 mol。则平衡时SO2的体积分数为 ;
Ⅱ.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当乙池中C极质量减轻10.8 g时,回答下列问题。

(1)甲池中B电极理论上消耗O2的体积(标准状况下) mL。
(2)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
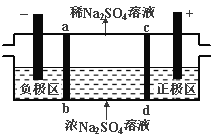
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在相同条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通入0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kJ。则下列关系式正确的是
A. 2Q2=Q1=92.4 B. Q2<Q1<92.4
C. Ql<Q2<92.4 D. Ql=Q2<92.4
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
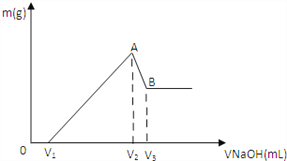
(1)写出A→B段反应的离子方程式_____________。
(2)A点沉淀的总物质的量n= _________________mol
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积为多少___________mol
(4)若V1=60mL,则混合物中Mg的物质的量为多少___________mol V3= ___________mL
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼铜的反应为:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.用稀盐酸浸取炉渣,过滤,除掉的杂质为 。
b.除去Al3+的离子方程式是 。
c.选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸 稀硫酸 KSCN溶液KMnO4溶液NaOH溶液所选试剂为 。证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
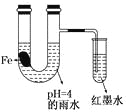
A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知Na2FeO4在强碱性溶液中会析出沉淀。其生产工艺流程如图所示:
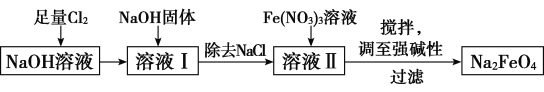
(1)写出向NaOH溶液中通入足量Cl2发生反应的离子方程式:_________________________。
(2)向溶液Ⅱ中加入Fe(NO3)3溶液发生反应,该反应的氧化剂是____________,每制得49.8 g Na2FeO4,理论上消耗氧化剂的物质的量为____________mol。
(3)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
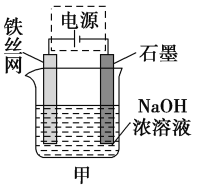
①电解过程中阳极的电极反应式为_______________________。
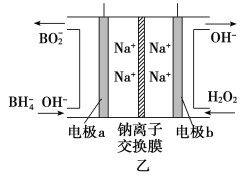
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图乙所示。工作过程中该电源的正极反应式为________________________,Na+由____________(填“a”或“b”,下同)极区移向____________极区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com