
科目: 来源: 题型:
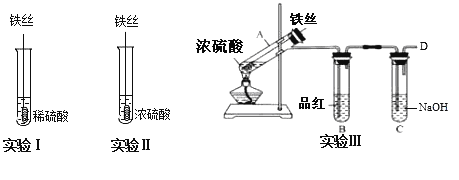
【题目】某同学在实验室研究Fe与H2SO4的反应
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__,装置C的作用是__.
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是(____)
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________.
②影响反应产物多样性的因素有_____________________(至少填两个).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 电子层结构相同的微粒,其化学性质—定相似
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 非金属元素的原子两两结合形成的化合物不一定是共价化合物
D. 元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示,下列有关叙述正确的是
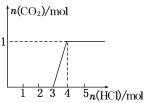
A.通入的CO2气体在标准状况下可能大于22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
科目: 来源: 题型:
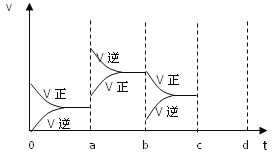
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3,如果2min内SO2的浓度由6mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为_____________,用O2浓度变化来表示的反应速率为___________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度____________
2SO3,如果2min内SO2的浓度由6mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为_____________,用O2浓度变化来表示的反应速率为___________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度____________
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件是 ;b c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.
2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件是 ;b c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
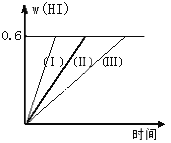
(1)达平衡时,I2(g)的物质的量浓度为____________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是____________,则乙条件可能是_____________ 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)_______
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、___________________。(填所缺仪器的名称)。
(4)在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:
__________________________________________________________
(6)若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1,则需要氨气的体积为________mL(标
准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com