
科目: 来源: 题型:
【题目】当配制一定物质的量浓度的溶液时,错误的操作会导致溶液的浓度发生改变. 不小心将溶液溅到烧杯外(填偏大、偏小或无影响)定容时俯视摇匀后,发现溶液低于刻度线,加水至刻度线 .
查看答案和解析>>
科目: 来源: 题型:
【题目】有一透明溶液,可能含有大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO![]() 、CO
、CO![]() 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:

(1)溶液中一定含有的离子是______________。
(2)溶液中肯定不含有的离子是________________。
(3)可能含有的离子是____________,若要确定该离子的存在需要用到的实验方法是____________
查看答案和解析>>
科目: 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】向容积为2 L的密闭容器中充入2 mol A和1 mol B,在一定条件下发生反应:2A(g)+B(g)![]() 3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol /(L·s)
②用物质B表示该反应的平均反应速率为0.2 mol /(L·s)
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其它条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O
B.氯化铁溶液和铜反应:Fe3++Cu=Cu2++Fe2+
C.NaHSO4溶液与NaOH溶液反应:OH-+HSO4-=SO42-+H2O
D.NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·-1的NaOH溶液。请回答:
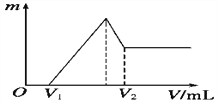
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=______________mol,V2=_____________ mL。
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。

(1) 实验前用碱液清洗铁钉,再用0.100 mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_________ _____。
(2) 为尽量减小误差,下列操作的正确顺序是 ___(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量NaCl溶液并打开止水夹
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3)实验中试管内发生的总反应化学方程式为 ;
用该实验方案测量空气中O2的体积百分数时应测量的数据是:
①导管与试管内部空间总体积,② _。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充写出假设三:
假设一:电解质溶液的pH
假设二:NaCl溶液的浓度
假设三:________________
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度 | 0 cm | 1.3 cm | 8.5 cm | 8.4 cm | 8.5 cm | 8.5 cm |
形成稳定 液柱时间 | 3.0 min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | min |
①当pH=2时,没有观察到稳定液柱形成的原因是_____________________。
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________________。
③按上述实验装置,设计实验证明假设二。
第一步:配制不同浓度的NaCl溶液;
第二步:____________________,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl;
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI;
3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O;
KCN+CO2+H2O=HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A.热稳定性:NaCl>NaClO4>NaClO
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
D.酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com