
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 漂白粉、铝热剂、盐酸、聚乙烯都是混合物
B. CO2、H2O、SO2、HClO都是氧化物
C. 胶体区别于其他分散系的本质特征是丁达尔效应
D. 糖类、油脂和蛋白质都属于天然高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中滴入紫色石蕊试液、硝酸银溶液,将依次观察到紫色石蕊试液先变红后退色、有白色沉淀产生等现象。这些现象与氯水所含的下列哪种微粒无直接关系?
A.HClO
B.H2O
C.Cl-
D.H+
查看答案和解析>>
科目: 来源: 题型:
【题目】FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 1:6 B.1:7 C.2:11 D.16:25
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
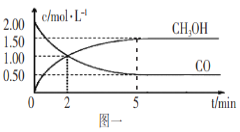
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小品粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的T艺流程如下图所示:
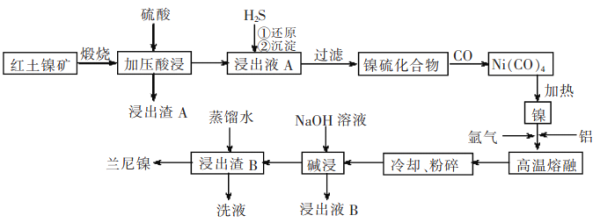
(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为________;
(2)已知红土镍矿煅烧后生成固体产物为Ni2O3和Fe2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式____________;
(3)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为__________。
(4)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:浸出液B→_______________。
(示例:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
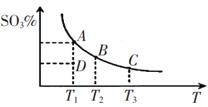
A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.195g锌粉加入到20.0mL 0.100 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是( )
A. M B. M2+ C. M3+ D. MO2+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物理量与其单位匹配正确的是( )
A. 质量---g B. 反应速率---mol·L-1
C. 摩尔质量---g·mol-1 D. 气体摩尔体积---L·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的 是( )
A.其单质的熔点比钠的熔点低
B.其氧化物对应的水化物的碱性很强
C.其原子半径在同一主族中是最大的
D.在空气中燃烧只能生成Fr2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com