
科目: 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
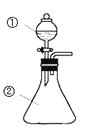
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Q和R的摩尔质量之比是9:22,在反应X+2Y=2Q+R中,当1.6gX与Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为
A.46:9
B.32:9
C.23:9
D.16:9
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是
A.Ba(OH)2+H2SO4=BaSO4↓+2H2O
B.BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
C.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
D.Ba(OH)2+2KHSO4=BaSO4↓+K2SO4+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀盐酸中,直到铁片完全溶解,经分析该溶液中无Fe3+ , 且生成的Fe2+与反应生成的H2的物质的量之比为3:1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A.1:1
B.2:5
C.4:1
D.3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
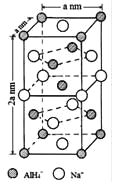
(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂,NaH属于 晶体,其电子式为 。
(3)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的一种离子和一种分子 、 (填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有 个;NaAlH4晶体的密度为 gcm-3(用含a的代数式表示).若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(5)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,分子中有两个配位键,蒸气分子的结构式为 (标明配位键)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构.这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】中华人民共和国国家标准(GB2760—2011)规定葡萄酒中SO2最大使用量为 0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。B中加入300.00ml葡萄酒和适里盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为SO2+H2O2= H2SO4

(1) 除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____________;
(2) 若滴定终点时溶液的pH=8.8,则选择的指示剂为_________;描述滴定至终点时的现象_____________。
(3) 若用50ml滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__ ________(①=10ml,②=40ml,③<l0mL ④>40ml)
(4) 滴定中消耗NaOH溶液体积为18.10mL。该葡萄酒中SO2含量为_______g/L。
(5) 该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________。(答出一点即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将amol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)
A.溶液中c(NH4+)=c(Cl-)
B.此时水的电离程度最大
C.此时溶液中NH3·H2O的物质的量浓度为1/2[(a-0.01)]mol/L
D.用含a 的代数式 NH3·H2O的电离平衡常数Kb=![]() (mol/L)
(mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com