
科目: 来源: 题型:
【题目】水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到160 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A. 玻璃态水中也存在范德华力与氢键作用 B. 玻璃态水的熔点是0 ℃
C. 玻璃态水中不存在氢键作用 D. 玻璃态水是分子晶体,晶胞与冰相似
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
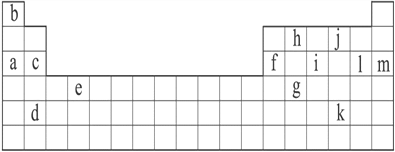
(1)下列___________ (填写编号)组成元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向。
Ⅱ.下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 | 9 550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子所需的能量远远大于失去第一个电子所需的能量。
____________________________。
②表中X可能为以上13种元素中的__________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式: __________。
③Y是周期表中__________族元素。
④以上13种元素中, __________ (填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”),可通过 方法鉴别。
(2)基态Ni2+的核外电子排布式 ;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是 ;写出一种与SCN—互为等电子体的分子 (用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
![]()
(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8B.NH3的结构式为H—![]() —H
—H
C.HCl的电子式为H+[![]() ]D.热稳定性:H2S>HI
]D.热稳定性:H2S>HI
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的熔点均按由高到低的排列,其原因是由于键能由大到小排列的是 ( )
A.铝、钠、干冰
B.金刚石、碳化硅、晶体硅
C.碘化氢、溴化氢、氯化氢
D.二氧化硅、二氧化碳、一氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可大量共存
C.常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com